题目内容
10.下列物质的水溶液中不存在溶质分子的是( )| A. | H2S | B. | HF | C. | HNO3 | D. | NH3•H2O |
分析 物质的水溶液中不存在溶质分子,说明该物质在水中完全电离,为强电解质,据此分析解答.
解答 解:物质的水溶液中不存在溶质分子,说明该物质在水中完全电离,为强电解质,H2S、HF、NH3•H2O在水中都部分电离,为弱电解质,只有HNO3在水中完全电离,为强电解质,硝酸溶液中不存在溶质分子,故选C.
点评 本题以电解质在水中的电离为载体考查强弱电解质,明确强弱电解质根本区别是解本题关键,不能根据电解质溶液导电性及电解质溶解性判断电解质强弱,为易错点.

练习册系列答案
 口算能手系列答案
口算能手系列答案
相关题目
20.用10mL的0.1mol•L-1 BaCl2溶液恰好可使相同体积的硫酸铁、硫酸锌和硫酸钾三种溶液中的硫酸根离子完全转化为硫酸钡沉淀,则三种硫酸盐溶液的物质的量浓度之比是( )
| A. | 3:2:2 | B. | 1:2:3 | C. | 1:3:3 | D. | 3:1:1 |
1.对已达化学平衡的下列反应 2X(g)+Y(g)?2Z(g),减小压强时,对反应产生的影响是( )
| A. | 逆反应速率增大,正反应速率减小 | B. | 逆反应速率减小,正反应速率增大 | ||
| C. | 逆反应速率先增大后减小 | D. | 正反应速率先减小后增大 |
18.下列物质中含原子个数最多的是( )
| A. | 0.4 molO2 | B. | 4℃时5.4mL水 | ||
| C. | 10g氖 | D. | 6.02×1022 个CO2分子 |
5.把金属钠投入下列溶液中,反应后溶液质量减轻的是( )
| A. | HCl | B. | Na2SO4 | C. | NaCl | D. | CuSO4 |
15.某烃的结构简式为: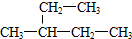 ,它的名称是( )
,它的名称是( )
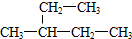 ,它的名称是( )
,它的名称是( )| A. | 3-乙基丁烷 | B. | 3-乙基戊烷 | C. | 2-乙基丁烷 | D. | 3-甲基戊烷 |
2.设NA为阿伏伽德罗常数的值.下列叙述正确的是( )
| A. | 2.4g镁变为镁离子失去的电子数为0.1NA | |
| B. | 电解精炼铜时,若阴极得到电子数为2NA个,则阳极质量减少64g | |
| C. | 标准状况下,2.24L四氯化碳含有分子的数目为0.1NA | |
| D. | 常温常压下,Na2O2与足量H2O反应,当生成0.2molO2时,转移电子的数目为0.4NA |
19.密闭的烧瓶里盛放气体A,在25℃时建立平衡:2A(g)?B(g)△H<0,把烧瓶置于100℃的沸水中,在建立新平衡的过程中,烧瓶内混合气体的物理量始终不变的是( )
| A. | 平均相对分子质量 | B. | 密度 | ||
| C. | 容器内的压强 | D. | 物质的量 |
20.向酸化的Fe(NO3)3溶液中逐渐通入H2S气体,可能发生的离子方程式正确的是( )
| A. | 3S2-+2NO3-+8H+→2NO↑+3S↓+4H2O | |
| B. | S2-+2NO3-+4H+→2NO2↑+S↓+2H2O | |
| C. | Fe3++3NO3-+5H2S+2H+→3NO↑+5S↓+Fe2++6H2O | |
| D. | Fe3++5NO3-+8H2S+4H+→5NO↑+8S↓+Fe2++10H2O |