题目内容
18.已知某溶液中只存在OH-、H+、Na+、CH3COO-四种离子,某同学推测该溶液中各离子浓度大小顺序可能有如下四种关系:A.c (CH3COO-)>c (Na+)>c (H+)>c (OH-)
B.c (CH3COO-)>c (Na+)>c (OH-)>c (H+)
C.c (CH3COO-)>c (H+)>c (Na+)>c (OH-)
D.c (Na+)>c(CH3COO-)>c (OH-)>c (H+)
(1)这四组关系中有一组是不可能的,这组关系是B(选填序号).
(2)若该溶液只有一种溶质,上述离子浓度大小顺序关系中正确的是(选填序号)D.
(3)若上述关系中C是正确的,则溶液中溶质的化学式是CH3COOH和CH3COONa.
(4)在25℃下,将a mol•L-1的醋酸与0.01mol•L-1的NaOH溶液等体积混合,反应平衡时溶液中c(Na+)=c(CH3COO-),则溶液显中性(填“酸”“碱”或“中”);则:混合前c(CH3COOH)>c(NaOH)(填“>”、“<”、或“=”),用含a的代数式表示CH3COOH的电离常数Ka=$\frac{1{0}^{-9}}{a-0.01}$.
分析 (1)任何电解质溶液中都存在电荷守恒,根据电荷守恒判断;
(2)任何电解质溶液中都含有氢离子和氢氧根离子,如果该溶液中只有一种溶质,则只能是含有醋酸根离子和钠离子的物质;醋酸钠溶液呈碱性,结合电荷守恒判断离子浓度大小;
(3)如果C是正确的,溶液呈酸性,醋酸钠是强碱弱酸盐,其溶液呈碱性,要使溶液呈酸性,则溶液中溶质为醋酸钠和醋酸;
(4)根据电荷守恒判断混合溶液中c(H+)、c(OH-)相对大小,从而确定溶液酸碱性;醋酸钠溶液呈碱性,要使混合溶液呈中性,则酸应该稍微过量;根据醋酸的电离平衡常数表达式及溶液中醋酸、醋酸根离子和氢离子浓度进行计算.
解答 解:(1)任何电解质溶液中都存在电荷守恒,B中阴离子电荷大于阳离子,根据电荷守恒,B错误,故选B;
(2)任何电解质溶液中都含有氢离子和氢氧根离子,如果该溶液中只有一种溶质,则只能是含有醋酸根离子和钠离子的物质,为醋酸钠,醋酸钠是强碱弱酸盐,醋酸根离子水解导致溶液呈碱性,但水解程度较小,根据电荷守恒得c(Na+)>c(CH3COO-),所以离子浓度大小顺序是c (Na+)>c(CH3COO-)>c (OH-)>c (H+)
,故选D;
(3)如果C是正确的,溶液呈酸性,醋酸钠是强碱弱酸盐,其溶液呈碱性,要使溶液呈酸性,则溶液中溶质为醋酸钠和醋酸,故答案为:CH3COOH和CH3COONa;
(4)根据电荷守恒判断混合溶液中c(H+)=c(OH-),所以该溶液呈中性;醋酸钠溶液呈碱性,要使混合溶液呈中性,则酸应该稍微过量,二者体积相等,则c(CH3COOH)>c(NaOH),.
在25℃下,将amol•L-1的稀醋酸与0.01mol•L-1的NaOH溶液等体积混合,反应平衡时溶液中c(CH3COO-)=c(Na+)=0.005mol/L,根据电荷守恒可得c(OH-)=c(H+),所以溶液显示中性,常温下的中性溶液中c(OH-)=c(H+)=10-7mol/L,
根据物料守恒可得,c(CH3COOH)=0.5amo/L-0.005mol/L=(0.5a-0.005)mol/L,
醋酸的电离平衡常数为:K=$\frac{c({H}^{+}).c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$=$\frac{1{0}^{-7}×0.005}{0.5a-0.005}$=$\frac{1{0}^{-9}}{a-0.01}$,
故答案为:中;>;$\frac{1{0}^{-9}}{a-0.01}$.
点评 本题考查酸碱中和反应定性判断及离子浓度大小比较,为高频考点,难点是(4)中弱电解质的电离及电离平衡常数计算方法,注意两种溶液混合后溶液浓度都减半,为易错点.

 中考解读考点精练系列答案
中考解读考点精练系列答案| A. | 分子内共价键越强,分子越稳定,其熔、沸点也越高 | |
| B. | 共价化合物溶于水,分子内共价键一定被破坏 | |
| C. | 离子键的形成一定有电子的得与失 | |
| D. | 分子晶体中一定存在分子间作用力,不一定存在共价键 |
| A. | 有机物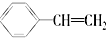 属于芳香烃,含有两种官能团 属于芳香烃,含有两种官能团 | |
| B. | 按系统命名法,化合物(CH3)2CHCH(CH3)CH2CH(CH3) CH(CH3)2的名称为2,3,5,6-四甲基庚烷 | |
| C. | 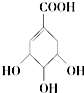 既属于酚类又属于羧酸类 既属于酚类又属于羧酸类 | |
| D. | 2甲基3丁烯的命名错误原因是选错了主链 |
| A. | 0.1 mol•L-1 | B. | 1 mol•L-1 | C. | 3 mol•L-1 | D. | 1.5 mol•L-1 |
为了测定在某种催化剂作用下的反应速率,在某温度下用气体传感器测得不同时间的NO和CO浓度如表:
| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO)(mol/L) | 1.00×10-3 | 4.50×10-4 | 2.50×10-4 | 1.50×10-4 | 1.00×10-4 | 1.00×10-4 |
| c(CO)(mol/L) | 3.60×10-3 | 3.05×10-3 | 2.85×10-3 | 2.75×10-3 | 2.70×10-3 | 2.70×10-3 |
(1)在上述条件下反应能够自发进行,则该反应的△H<0(填写“>”、“<”、“=”).
(2)假设在密闭容器中发生上述反应,达到平衡时下列措施能提高NO转化率的是CD.
A.选用更有效的催化剂 B.升高反应体系的温度
C.降低反应体系的温度 D.缩小容器的体积
(3)某同学设计了三组实验,实验条件已经填在下面实验设计表中,分析表格我们可以看出该同学的实验目的主要是研究温度和催化剂比表面积对化学反应速率的影响.
| 实验编号 | T(℃) | NO初始浓(mol/L) | CO初始浓度(mol/L) | 催化剂的比表面积(m2/g) |
| Ⅰ | 280 | 1.20×10-3 | 5.80×10-3 | 82 |
| Ⅱ | 280 | 1.20×10-3 | 5.80×10-3 | 124 |
| Ⅲ | 350 | 1.20×10-3 | 5.80×10-3 | 124 |
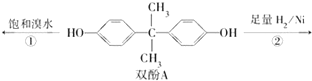 用双酚A作食品、饮料包装和奶瓶等塑料制品的添加剂,能导致人体内分泌失调,对儿童的健康危害更大.双酚A可发生如下的反应①和②,下列有关双酚A的叙述不正确的是( )
用双酚A作食品、饮料包装和奶瓶等塑料制品的添加剂,能导致人体内分泌失调,对儿童的健康危害更大.双酚A可发生如下的反应①和②,下列有关双酚A的叙述不正确的是( )| A. | 双酚A的分子式是C15H16O2 | |
| B. | 反应①中,1 mol双酚A最多消耗2 mol Br2 | |
| C. | 双酚A的核磁共振氢谱显示氢原子数之比是1:2:2:3 | |
| D. | 反应②的产物中只有一种官能团 |
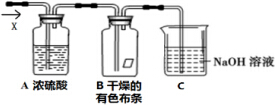 某同学应用如图所示装置研究物质的性质.其中气体X的主要成分是氯气,还含有少量空气和水蒸气.请回答下列问题:
某同学应用如图所示装置研究物质的性质.其中气体X的主要成分是氯气,还含有少量空气和水蒸气.请回答下列问题: