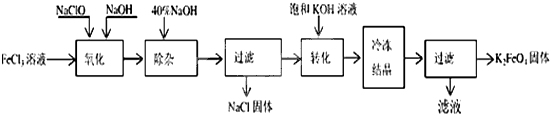
5.氧化锌粉末广泛应用于橡胶、涂料、陶瓷、化工、医药、玻璃等行业,为综合应用资源,常从冶炼锌、锌制品加工企业回收的锌渣(含有ZnO、FeO、Fe2O3、CuO、Al2O3等杂质)来制取氧化锌,流程如图:

有关氢氧化物沉淀完全的pH见表
(1)在酸浸过程中,常将锌渣碎成粉末的目的是增大接触面积,提高锌的浸出速率.
(2)上述工艺多处涉及“过滤”,实验室中过滤需要使用的玻璃仪器有烧杯、玻璃棒、漏斗.
(3)①在“除杂Ⅰ”中,常用酸性KMnO4溶液,其目的是将Fe2+ 转化成为Fe3+,请写出该反应的离子方程式5Fe2++2MnO4-+16H+=2Mn2++5Fe3++8H2O.将溶液的pH调至4,目的是让三价铁转化为氢氧化铁沉淀而除去.②在“除杂Ⅱ”中,加入锌粉的目的是除去溶液中的Cu2+.
(4)在“碳化合成”中,产物中有碱式碳酸锌[Zn2(OH)2CO3]和CO2等,请写出该反应的化学方程式2Na2CO3+2Zn(NO3)2+H2O=[Zn2(OH)2CO3+CO2+4NaNO3.

有关氢氧化物沉淀完全的pH见表
| 沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 | Zn(OH)2 |
| PH | 5.2 | 3.2 | 9.7 | 6.7 | 8.0 |
(2)上述工艺多处涉及“过滤”,实验室中过滤需要使用的玻璃仪器有烧杯、玻璃棒、漏斗.
(3)①在“除杂Ⅰ”中,常用酸性KMnO4溶液,其目的是将Fe2+ 转化成为Fe3+,请写出该反应的离子方程式5Fe2++2MnO4-+16H+=2Mn2++5Fe3++8H2O.将溶液的pH调至4,目的是让三价铁转化为氢氧化铁沉淀而除去.②在“除杂Ⅱ”中,加入锌粉的目的是除去溶液中的Cu2+.
(4)在“碳化合成”中,产物中有碱式碳酸锌[Zn2(OH)2CO3]和CO2等,请写出该反应的化学方程式2Na2CO3+2Zn(NO3)2+H2O=[Zn2(OH)2CO3+CO2+4NaNO3.
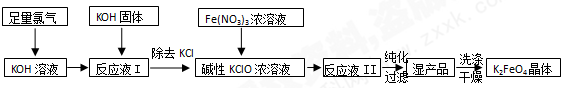
2.溴化钙在医药上用作中枢神经抑制药,实验室用“尿素法”制备溴化钙的主要流程如下:

溴化钙的部分溶解度数值如下:
(1)6Ca(OH)2+6Br2 $\frac{\underline{\;50~70℃\;}}{\;}$5CaBr2+6H2O+Ca(BrO3)2,每生成1mol Ca(BrO3)2转移电子的物质的量为10mol;50~70℃时,尿素[CO(NH2)2]将生成的Ca(BrO3)2还原为CaBr2,尿素被氧化为N2,该反应的化学方程式为2CO(NH3)2+Ca(BrO3)2$\stackrel{50℃--70℃}{→}$CaBr2+2CO2↑+2N2↑+4H2O.
(2)过滤所需的玻璃仪器有玻璃棒、漏斗,烧杯.
(3)加入氢溴酸调pH的作用是除去过量的氢氧化钙.
(4)操作I包括蒸发浓缩、冷却结晶、过滤、冰水洗涤(或乙醇洗涤)、干燥.
(5)“二氧化硫法”制备的氢溴酸粗品中常含有少量的溴和硫酸;请选用所提供的试剂,补充完整检验氢溴酸粗品中是否含有Br2相SO42-的实验方案.①取少量的氢溴酸粗产生与试管中,滴加少量植物油,将长滴管插入液面下滴加淀粉KI溶液变为蓝色,说明含有Br2,否则不含有Br2;
②另取少量氢溴酸粗产品与试管中,滴加少量稀盐酸,再加入BaCl2溶液,若产生白色沉淀,说明含有SO42-,否则不含SO42-限选下列试剂:氯水、淀粉KI溶液、CCl4、BaCl2溶液、稀盐酸、植物油.
0 172713 172721 172727 172731 172737 172739 172743 172749 172751 172757 172763 172767 172769 172773 172779 172781 172787 172791 172793 172797 172799 172803 172805 172807 172808 172809 172811 172812 172813 172815 172817 172821 172823 172827 172829 172833 172839 172841 172847 172851 172853 172857 172863 172869 172871 172877 172881 172883 172889 172893 172899 172907 203614

溴化钙的部分溶解度数值如下:
| 温度 | 0℃ | 10℃ | 20℃ | 40℃ | 60℃ | 80℃ | 100℃ |
| 溶解度(g) | 125 | 132 | 143 | 213 | 278 | 295 | 312 |
(2)过滤所需的玻璃仪器有玻璃棒、漏斗,烧杯.
(3)加入氢溴酸调pH的作用是除去过量的氢氧化钙.
(4)操作I包括蒸发浓缩、冷却结晶、过滤、冰水洗涤(或乙醇洗涤)、干燥.
(5)“二氧化硫法”制备的氢溴酸粗品中常含有少量的溴和硫酸;请选用所提供的试剂,补充完整检验氢溴酸粗品中是否含有Br2相SO42-的实验方案.①取少量的氢溴酸粗产生与试管中,滴加少量植物油,将长滴管插入液面下滴加淀粉KI溶液变为蓝色,说明含有Br2,否则不含有Br2;
②另取少量氢溴酸粗产品与试管中,滴加少量稀盐酸,再加入BaCl2溶液,若产生白色沉淀,说明含有SO42-,否则不含SO42-限选下列试剂:氯水、淀粉KI溶液、CCl4、BaCl2溶液、稀盐酸、植物油.