题目内容
7.新型净水剂高铁酸钾(K2FeO4)为暗紫色固体,可溶于水,在中性或酸性溶液中逐渐分解,在碱性溶液中稳定.工业上制备K2FeO4的常用方法有两种.方法Ⅰ:次氯酸盐氧化法.工艺流程如图所示.
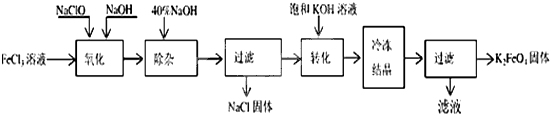
(1)完成“氧化”过程中反应的化学方程式:
2FeCl3+10NaOH+3NaClO=2Na2FeO4+9NaCl+5H2O
其中氧化剂是:NaClO,当有0.2molNa2FeO4生成,转移电子的数目为:0.6NA,
(2)写出“转化”过程中发生反应的化学方程式为Na2FeO4+2KOH=K2FeO4+2NaOH,
(3)上述工艺得到的高铁酸钾常含有杂质,可用重结晶法提纯操作是:将粗产品用B溶解
A.H2O B.稀NaOH溶液 C.稀KOH溶液 D.稀H2SO4
然后加入饱和KOH溶液 溶液,冷却结晶.
方法Ⅱ:电解法.以铁为阳极电解氢氧化钠溶液,然后在阳极溶液中加入KOH.
(4)电解时阳极发生反应生成FeO42-,该电极反应方程式为Fe+8OH--6e-=FeO42-+4H2O
(5)K2FeO4作为一种很好的水处理剂,有双重作用,能够杀菌是利用其氧化性,净水原理是:
Fe3++3H2O?Fe(OH)3+3H+(用离子方程式表示)
分析 氯化铁溶液、次氯酸钠溶液和氢氧化钠溶液混合发生氧化还原反应生成高铁酸钠、氯化钠和水,加入40%的氢氧化钠溶液除杂,过滤得到氯化钠固体和滤液,滤液中加入氢氧化钾溶液实现高铁酸钠转化为高铁酸钾沉淀,冷却结晶过滤得到高铁酸钾固体,上述工艺得到的高铁酸钾常含有杂质,可用重结晶法提纯,
(1)反应中NaClO是氧化剂,还原产物是NaCl,根据元素守恒,可知反应式中需要补充NaCl和H2O.根据化合价升降法配平方程式.
(2)由工艺流程可知,“氧化”过程除杂后的滤液中含有Na2FeO4,“转化”过程的产物为K2FeO4,故“转化”过程是在加入KOH溶液后,将Na2FeO4转化为溶解度更小的K2FeO4.
(3)由题目信息可知,K2FeO4可溶于水,在中性或酸性溶液中能分解,在碱性溶液中稳定,在分离提提纯的时候就要在碱性环境中进行,要防止引入新杂质,所以需要将K2FeO4粗产品在稀KOH溶液中溶解,然后加入饱和KOH溶液,冷却结晶.
(4)由题目信息可知,铁为阳极电解氢氧化钠溶液,生成FeO42-,由元素守恒还生成水;
(5)K2FeO4中铁元素化合价为+6价,具有强氧化性,可以杀菌消毒,被还原剂还原为铁离子,铁离子水解生成氢氧化铁胶体,可以吸附悬浮杂质起到净水的主要作用.
解答 解:(1)反应中FeCl3→Na2FeO4,铁元素化合价由+3价升高为+6价,化合价总升高3价,NaClO→NaCl,氯元素化合价由+1降低为-1价,化合价总共降低2价,化合价升降最小公倍数为6,故FeCl3系数为2,NaClO系数为3,由铁元素守恒可知 Na2FeO4系数为2,由氯元素守恒可知NaCl系数为2×3+3=9,根据钠元素守恒可知NaOH系数为9+2×2=13,由氢元素守恒可知H2O系数为5,配平方程式为2FeCl3+10NaOH+3NaClO=2Na2FeO4+9NaCl+5H2O,反应中NaClO是氧化剂,还原产物是NaCl,化学方程式中生成2molNa2FeO4,、电子转移为6mole-,当有0.2molNa2FeO4生成,转移电子的数目为0.6mol,电子数为0.6NA,
故答案为:2、10、3、2、9NaCl、5,NaClO,0.6NA;
(2)“转化”过程是在加入KOH溶液后,将Na2FeO4转化为溶解度更小的K2FeO4,反应方程式为Na2FeO4+2KOH=K2FeO4+2NaOH,
故答案为:Na2FeO4+2KOH=K2FeO4+2NaOH;
(3)由题目信息可知,K2FeO4可溶于水,在中性或酸性溶液中能分解,在碱性溶液中稳定,在分离提提纯的时候就要在碱性环境中进行,要防止引入新杂质,所以需要将K2FeO4粗产品在稀KOH溶液中溶解,然后加入饱和KOH溶液,冷却结晶,过滤,
故答案为:B;饱和KOH溶液;
(4)由题目信息可知,铁为阳极电解氢氧化钠溶液,生成FeO42-,阳极电极反应式为Fe+8OH--6e-=FeO42-+4H2O,
故答案为:Fe+8OH--6e-=FeO42-+4H2O;
(5)K2FeO4中铁元素化合价为+6价,具有强氧化性,可以杀菌消毒,被还原剂还原为铁离子,铁离子水解生成氢氧化铁胶体,反应的离子方程式为:Fe3++3H2O?Fe(OH)3+3H+,可以吸附悬浮杂质起到净水的主要作用,
故答案为:氧化性;Fe3++3H2O?Fe(OH)3+3H+.
点评 本题考查方程式的书写、基本的实验操作、阅读题目获取信息能力等,难度中等,需要学生具备综合运用知识及题目信息分析问题、解决问题能力.对于这类题目,需要搞清楚每一步反应物、生成物,清楚工艺流程原理,题目难度中等.

 阅读快车系列答案
阅读快车系列答案
溴化钙的部分溶解度数值如下:
| 温度 | 0℃ | 10℃ | 20℃ | 40℃ | 60℃ | 80℃ | 100℃ |
| 溶解度(g) | 125 | 132 | 143 | 213 | 278 | 295 | 312 |
(2)过滤所需的玻璃仪器有玻璃棒、漏斗,烧杯.
(3)加入氢溴酸调pH的作用是除去过量的氢氧化钙.
(4)操作I包括蒸发浓缩、冷却结晶、过滤、冰水洗涤(或乙醇洗涤)、干燥.
(5)“二氧化硫法”制备的氢溴酸粗品中常含有少量的溴和硫酸;请选用所提供的试剂,补充完整检验氢溴酸粗品中是否含有Br2相SO42-的实验方案.①取少量的氢溴酸粗产生与试管中,滴加少量植物油,将长滴管插入液面下滴加淀粉KI溶液变为蓝色,说明含有Br2,否则不含有Br2;
②另取少量氢溴酸粗产品与试管中,滴加少量稀盐酸,再加入BaCl2溶液,若产生白色沉淀,说明含有SO42-,否则不含SO42-限选下列试剂:氯水、淀粉KI溶液、CCl4、BaCl2溶液、稀盐酸、植物油.
| A. | 常温下,4Fe(OH)2(s)+2H2O(l)+O2(g)═4Fe(OH)3(s)能自发进行,则该反应的△H<0 | |
| B. | 检验某物质是否含有Fe2O3的操作步骤是:样品粉碎→加水溶解→过滤,向滤液中滴加KSCN溶液 | |
| C. | 锌与稀硫酸反应时加少量硫酸铜,反应加快的主要原因是Cu2+水解增大了H+浓度 | |
| D. | 甲基苯环上的一个氢原子被含3个碳原子的烷基取代的产物可能有3种 |
 医药商店销售的某种葡萄糖(化学式C6H12O6)注射液部分说明如图,测得该葡萄糖注射液中碳元素质量分数为20%.请回答下列问题:
医药商店销售的某种葡萄糖(化学式C6H12O6)注射液部分说明如图,测得该葡萄糖注射液中碳元素质量分数为20%.请回答下列问题:
 苯乙酸铜是合成优良催化剂、传感材料--纳米氧化铜的重要前驱体之一.下面是它的一种实验室合成路线:
苯乙酸铜是合成优良催化剂、传感材料--纳米氧化铜的重要前驱体之一.下面是它的一种实验室合成路线:
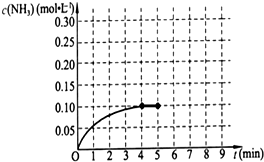 已知工业上合成氨的反应为:N2(g)+3H2(g)?2NH3(g)△H<0.在一体积为2L的密闭容积中,加入0.20mol的N2和0.60mol的H2,反应中NH3的物质的量浓度的变化情况如图所示,
已知工业上合成氨的反应为:N2(g)+3H2(g)?2NH3(g)△H<0.在一体积为2L的密闭容积中,加入0.20mol的N2和0.60mol的H2,反应中NH3的物质的量浓度的变化情况如图所示,