4.25℃,下列溶液的pH值最小的是( )
| A. | 0.01mol•L-1HCl | B. | pH=2的H2SO4溶液 | ||
| C. | c(OH)=10-13mol•L-1 | D. | pH=1溶液加水稀释1倍 |
3.在指定环境中可能大量共存的离子组是( )
| A. | 在c(H+)=1.0×10-13mol•L-1的溶液中:Na+、S2-、AlO2-、SO32- | |
| B. | 在由水电离出的c(H+)=1×10-12mol/L的溶液中:Fe2+ NO3- Na+ SO42- | |
| C. | 使甲基橙变红的溶液中:NH4+、K+、ClO-、Cl- | |
| D. | 能与Al反应放出H2的溶液中:K+、Cu2+、Cl-、NO3- |
2.有两位同学在条件相同的情况下,测定可逆反应:A2+3B2?2Χ2的化学反应速率.甲测得:v(A2)=0.5mol/(L•min),乙测得:v(B2)=1.5mol/(L•min),则这两位同学的测定结果( )
| A. | 都正确 | B. | 都不正确 | C. | 甲正确,乙不正确 | D. | 都对或都错 |
1.下列实验中,所采取的分离方法与对应原理都正确的是( )
| 选项 | 目的 | 分离方法 | 原理 |
| A | 分离氢氧化铁胶体和氯离子 | 过滤 | 胶体不能透过半透膜,离子能 |
| B | 除去乙醇中的乙酸 | 蒸馏 | 先加生石灰,利用乙醇与乙酸盐沸点相差较大 |
| C | 除去苏打中少量小苏打 | 加热 | 二者的溶解度不同 |
| D | 分离植物油和水的混合物 | 分液 | 二者互不相溶且沸点不同 |
| A. | A | B. | B | C. | C | D. | D |
19.下列内容与结论相对应的是( )
| 选项 | 内 容 | 结论或原因 |
| A | H2O(g)变成H2O(l) | △S>0 |
| B | 硝酸铵溶于水可自发进行 | 因为△S>0 |
| C | 一个反应的△H>0,△S>0 | 反应一定不自发进行 |
| D | 一个反应的△H<0,△S<0 | 反应在任意条件下均可自发进行 |
| A. | A、 | B. | B、 | C. | C、 | D. | D、 |
17.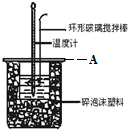 分别取40mL 的0.50mol/L盐酸与 0.55mol/L NaOH溶液进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
分别取40mL 的0.50mol/L盐酸与 0.55mol/L NaOH溶液进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
(1)理论上稀强酸、稀强碱反应生成1mol水时放出57.3kJ的热,写出表示稀硫酸和稀氢氧化钠溶液反应的中和热的热化学方程式NaOH(aq)+$\frac{1}{2}$H2SO4(aq)═$\frac{1}{2}$Na2SO4(aq)+H2O (l)△H=-57.3 kJ/mol;
(2)A为泡沫塑料板,上面有两个小孔,分别插入温度计和环形玻璃棒,两个小孔不能开得过大,其原因是减少热量散失;反应需要测量温度,每次测量温度后都必须用水将温度计上的液体冲掉,并擦干温度计;
(3)假设盐酸和氢氧化钠溶液的密度都是1g/cm3,又知中和后生成溶液的比热容c=4.18J/(g•℃).实验时,还需测量的数据有ACE;
A.反应前盐酸溶液的温度 B.反应前盐酸溶液的质量
C.反应前氢氧化钠溶液的温度 D.反应前氢氧化钠溶液的质量
E.反应后混合溶液的最高温度 F.反应后混合溶液的质量
(4)某学生实验记录数据如下:
依据该学生的实验数据计算,该实验测得的中和热为△H=-51.8kJ/mol;
(5)假定该学生的操作完全同上,实验中改用100mL 0.50mol/L盐酸跟100mL0.55mol/L NaOH溶液进行反应,与上述实验相比,所放出的热量不相等(填“相等”或“不相等”),所求中和热相等(填“相等”或“不相等”).
 分别取40mL 的0.50mol/L盐酸与 0.55mol/L NaOH溶液进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
分别取40mL 的0.50mol/L盐酸与 0.55mol/L NaOH溶液进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:(1)理论上稀强酸、稀强碱反应生成1mol水时放出57.3kJ的热,写出表示稀硫酸和稀氢氧化钠溶液反应的中和热的热化学方程式NaOH(aq)+$\frac{1}{2}$H2SO4(aq)═$\frac{1}{2}$Na2SO4(aq)+H2O (l)△H=-57.3 kJ/mol;
(2)A为泡沫塑料板,上面有两个小孔,分别插入温度计和环形玻璃棒,两个小孔不能开得过大,其原因是减少热量散失;反应需要测量温度,每次测量温度后都必须用水将温度计上的液体冲掉,并擦干温度计;
(3)假设盐酸和氢氧化钠溶液的密度都是1g/cm3,又知中和后生成溶液的比热容c=4.18J/(g•℃).实验时,还需测量的数据有ACE;
A.反应前盐酸溶液的温度 B.反应前盐酸溶液的质量
C.反应前氢氧化钠溶液的温度 D.反应前氢氧化钠溶液的质量
E.反应后混合溶液的最高温度 F.反应后混合溶液的质量
(4)某学生实验记录数据如下:
| 实验序号 | 起始温度t1/℃ | 终止温度t2/℃ | |
| 盐酸 | 氢氧化钠 | 混合溶液 | |
| 1 | 20.0 | 20.1 | 23.2 |
| 2 | 20.2 | 20.4 | 23.4 |
| 3 | 20.5 | 20.6 | 23.6 |
(5)假定该学生的操作完全同上,实验中改用100mL 0.50mol/L盐酸跟100mL0.55mol/L NaOH溶液进行反应,与上述实验相比,所放出的热量不相等(填“相等”或“不相等”),所求中和热相等(填“相等”或“不相等”).
16.下列说法中正确的是( )
0 172691 172699 172705 172709 172715 172717 172721 172727 172729 172735 172741 172745 172747 172751 172757 172759 172765 172769 172771 172775 172777 172781 172783 172785 172786 172787 172789 172790 172791 172793 172795 172799 172801 172805 172807 172811 172817 172819 172825 172829 172831 172835 172841 172847 172849 172855 172859 172861 172867 172871 172877 172885 203614
| A. | 互为同分异构体的物质具有相同的分子式 | |
| B. | 同系物的分子中各元素的原子个数比都相同 | |
| C. | 含元素种类相同而结构不同的化合物互称为同分异构体 | |
| D. | 具有相同通式,分子组成相差若干个-CH2原子团的有机物互称同系物 |