题目内容
4.25℃,下列溶液的pH值最小的是( )| A. | 0.01mol•L-1HCl | B. | pH=2的H2SO4溶液 | ||
| C. | c(OH)=10-13mol•L-1 | D. | pH=1溶液加水稀释1倍 |
分析 pH=-lgC(H+),物质的水溶液中,pH最小,说明该溶液中氢离子浓度最大,根据电解质的特点结合溶液的酸碱性判断.
解答 解:A.HCl为强酸,0.01mol•L-1HCl溶液中c(H+)=0.01mol/L;
B.硫酸为二元强酸,pH=2的H2SO4溶液中c(H+)=10-2 mol/L=0.01mol/L;
C.c(OH-)=10-13mol•L-1时,c(H+)=$\frac{1{0}^{-14}}{1{0}^{-13}}$=0.1mol/L;
D.pH=1溶液加水稀释1倍,溶液的pH大于1,所以c(H+)<0.1mol/L;
所以氢离子浓度最大的是C,
故选C.
点评 本题难度不大,掌握溶液的酸碱性和溶液pH大小之间的关系是解本题的关键,试题培养了学生的分析、理解能力.

练习册系列答案
相关题目
19.下列内容与结论相对应的是( )
| 选项 | 内 容 | 结论或原因 |
| A | H2O(g)变成H2O(l) | △S>0 |
| B | 硝酸铵溶于水可自发进行 | 因为△S>0 |
| C | 一个反应的△H>0,△S>0 | 反应一定不自发进行 |
| D | 一个反应的△H<0,△S<0 | 反应在任意条件下均可自发进行 |
| A. | A、 | B. | B、 | C. | C、 | D. | D、 |
9.下列物质中,属于碱性氧化物的是( )
| A. | CaO | B. | CO | C. | P2O5 | D. | CO2 |
16. 如图所示为某原电池的结构示意图,下列说法不正确的是(盐桥中装满用饱和KCl溶液和琼胶做成的冻胶)( )
如图所示为某原电池的结构示意图,下列说法不正确的是(盐桥中装满用饱和KCl溶液和琼胶做成的冻胶)( )
 如图所示为某原电池的结构示意图,下列说法不正确的是(盐桥中装满用饱和KCl溶液和琼胶做成的冻胶)( )
如图所示为某原电池的结构示意图,下列说法不正确的是(盐桥中装满用饱和KCl溶液和琼胶做成的冻胶)( )| A. | 该原电池的总反应式为2Fe3++Cu=2Fe2++Cu2+ | |
| B. | 电池工作过程中,电子由铜电极经过电流表流向石墨电极 | |
| C. | 该电池工作时,Cu2+在电极上得到电子,发生还原反应 | |
| D. | 若用此电池电解饱和氯化钠溶液制取Cl2,当铜电极的质量减少6.4 g时,产生标准状况下氯气的体积为2.24 L |

 爆鸣声和火花;然后过滤、洗涤、干燥;最后称量、计算,测得其产率只有预期值的63%左右。
爆鸣声和火花;然后过滤、洗涤、干燥;最后称量、计算,测得其产率只有预期值的63%左右。
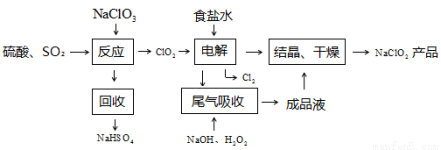
 化合价为 。
化合价为 。