5.设NA为阿伏加德罗常数的值,下列说法正确的是( )
| A. | 标准状况下,5.6L CO2与足量Na2O2反应转移的电子数为0.5NA | |
| B. | 2L 0.5mol•L-1亚硫酸溶液中含有的H+数为2NA | |
| C. | 过氧化钠与水反应时,生成0.1mol氧气转移的电子数为0.4NA | |
| D. | 钠在空气中燃烧可生成多种氧化物,23g钠充分燃烧时转移电子数为1NA |
4.将2.8g CO和0.2g H2在足量的氧气中充分燃烧,使生成的CO2和水蒸气通过过量的过氧化钠,完全反应后固体的质量变化量是( )
| A. | 增加了3.0g | B. | 减少了3.0g | C. | 增加了2.6g | D. | 减少了2.6g |
3.下列有关实验的操作正确的是( )
| A. | 容量瓶可以用来溶解或稀释溶液 | |
| B. | 与硫酸铜溶液反应时可以取用大块的钠 | |
| C. | 可以用排饱和食盐水的方法收集氯气 | |
| D. | 制备氢氧化铁胶体时,需要不断加热和搅拌 |
17.25℃时,下列有关溶液中微粒的物质的量浓度关系正确的是( )
| A. | 0.1 mol•L-1pH=4的NaHA溶液中:c(Na+)=c(HA-)+2c(A2-) | |
| B. | 在0.1 mol•L-1Na2CO3溶液中:c(OH-)+c(H+)=c(HCO3-)+2c(H2CO3) | |
| C. | pH相等的①CH3COONa ②NaHCO3 ③NaClO三种溶液的c(Na+):①>②>③ | |
| D. | NH3•H2O和NH4Cl的混合溶液[pH=7,c(Cl-)=0.1 mol•L-1]:c(NH4+)>c(Cl-)>c(H+)=c(OH-) |
16.下列设计的实验方案能达到实验目的是( )
0 172644 172652 172658 172662 172668 172670 172674 172680 172682 172688 172694 172698 172700 172704 172710 172712 172718 172722 172724 172728 172730 172734 172736 172738 172739 172740 172742 172743 172744 172746 172748 172752 172754 172758 172760 172764 172770 172772 172778 172782 172784 172788 172794 172800 172802 172808 172812 172814 172820 172824 172830 172838 203614
| A. | 制备O2:用Na2O2或H2O2作反应物可选择相同的气体发生装置 | |
| B. | 提纯含有少量HCl的Cl2:将含有少量HCl的Cl2通入饱和的NaHCO3溶液和浓硫酸中净化气体 | |
| C. | 检验溶液中是否含有CO32-:向溶液中加入盐酸,生成的气体能使澄清石灰水变浑浊,则原溶液中一定有大量的CO32- | |
| D. | 探究测定铝箔中氧化铝含量:取a g铝箔与足量稀盐酸充分反应,逸出的气体通过碱石灰后,测其体积为b L(标准状况) |
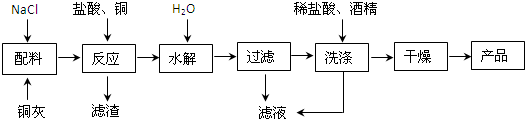
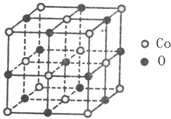 我国为钴(Co)消费大国,以化合物形式消费的钴主要用作催化剂、磁性材料、电池材料、超硬材料、干燥剂、颜料与染料等领域.
我国为钴(Co)消费大国,以化合物形式消费的钴主要用作催化剂、磁性材料、电池材料、超硬材料、干燥剂、颜料与染料等领域.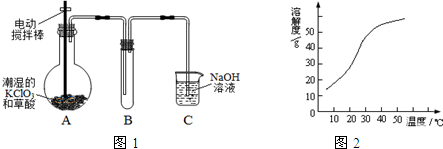
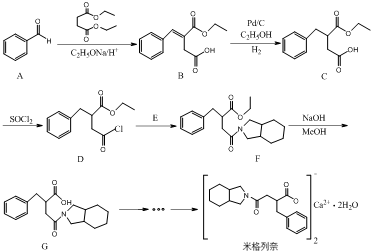
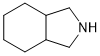 .
.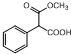 )为C的同系物,写出符合下列条件的X的一种同分异构体的结构简式:
)为C的同系物,写出符合下列条件的X的一种同分异构体的结构简式: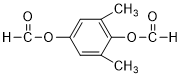 或
或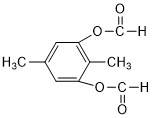 或
或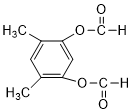 (以上一种即可).
(以上一种即可).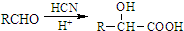 ②
②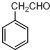 为原料制备
为原料制备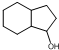 的合成路线流程图(无机试剂任用).合成路线流程图示例如下:
的合成路线流程图(无机试剂任用).合成路线流程图示例如下: