15.超音速飞机在平流层飞行时,尾气中的NO会破坏臭氧层.科学家正在研究利用催化技术将尾气中的NO和CO转变成CO2和N2,其反应为:2NO+2CO$\stackrel{催化剂}{?}$2CO2+N2.为了测定在某种催化剂作用下的反应速率,在某温度下用气体传感器测得不同时间的NO和CO浓度如表:
请回答下列问题(均不考虑温度变化对催化剂催化效率的影响):
(1)在上述条件下反应能够自发进行,则反应的△H<0(填写“>”、“<”、“=”).
(2)前2s内的平均反应速率v(N2)=1.88×10-4mol•L-1•s-1.
(3)在该温度下,反应的平衡常数K=5000.
(4)假设在密闭容器中发生上述反应,达到平衡时下列措施能提高NO转化率的是C、D.
A.选用更有效的催化剂B.升高反应体系的温度
C.降低反应体系的温度D.缩小容器的体积
(5)研究表明:在使用等质量催化剂时,增大催化剂比表面积可提高化学反应速率.为了分别验证温度、催化剂比表面积对化学反应速率的影响规律,某同学设计了三组实验,部分实验条件已经填在下面实验设计表中.
请在上表空格中填入剩余的实验条件数据.
| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO)(mol/L) | 1.00×10-3 | 4.50×10-4 | 2.50×10-4 | 1.50×10-4 | 1.00×10-4 | 1.00×10-4 |
| c(CO)(mol/L) | 3.60×10-3 | 3.05×10-3 | 2.85×10-3 | 2.75×10-3 | 2.70×10-3 | 2.70×10-3 |
(1)在上述条件下反应能够自发进行,则反应的△H<0(填写“>”、“<”、“=”).
(2)前2s内的平均反应速率v(N2)=1.88×10-4mol•L-1•s-1.
(3)在该温度下,反应的平衡常数K=5000.
(4)假设在密闭容器中发生上述反应,达到平衡时下列措施能提高NO转化率的是C、D.
A.选用更有效的催化剂B.升高反应体系的温度
C.降低反应体系的温度D.缩小容器的体积
(5)研究表明:在使用等质量催化剂时,增大催化剂比表面积可提高化学反应速率.为了分别验证温度、催化剂比表面积对化学反应速率的影响规律,某同学设计了三组实验,部分实验条件已经填在下面实验设计表中.
| 实验 编号 | T(℃) | NO初始浓度 (mol/L) | CO初始浓度 (mol/L) | 催化剂的比表面积(m2/g) |
| Ⅰ | 280 | 1.20×10-3 | 5.80×10-3 | 82 |
| Ⅱ | 124 | |||
| Ⅲ | 350 | 124 |
14.三氯化磷(PCl3)是一种重要的有机合成催化剂.实验室常用红磷与干燥的Cl2制取PCl3,装置如图1所示.
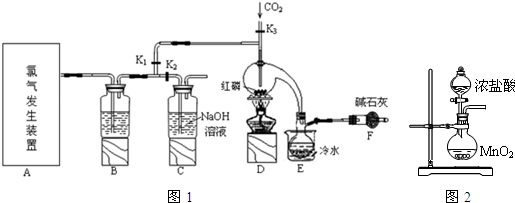
已知:红磷与少量Cl2反应生成PCl3,与过量Cl2反应生成PCl5.PCl3遇O2会生成POCl3(三氯氧磷),POCl3溶于PCl3,PCl3遇水会强烈水解生成H3PO3和HCl.PCl3、POCl3的熔沸点见表.
请答下面问题:
(1)B中所装试剂是浓硫酸,F中碱石灰的作用是吸收多余的Cl2,防止空气中的水蒸气进入烧瓶与PCl3反应.
(2)实验时,检查装置气密性后,向D装置的曲颈甑中加入红磷,打开K3通入干燥的CO2,一段时间后,关闭K3,加热曲颈甑至上部有黄色升华物出现时通入氯气,反应立即进行.通干燥CO2的作用是排尽装置中的空气,防止红磷自燃,
(3)实验制得的粗产品中常含有POCl3、PCl5等.加入红磷加热除去PCl5后,通过蒸馏(填实验操作名称),即可得到较纯净的PCl3.
(4)C装置中的K1、K2的设计也出于类似的目的,为了达到这一实验目的,实验时与K1、K2有关的操作是先关闭K1,打开K2,等B中溶液上方充满黄绿色气体后,打开K1,关闭K2.
(5)实验后期关闭K1,打开K2,将气体通入C装置中发生反应,反应后的溶液为X.某同学设计实验来确定溶液X中含有的某些离子,请补充完成实验步骤和现象.
(6)玻璃管之间的连接需要用到胶皮管,连接的方法是:先把把玻璃管口用水润湿,然后稍稍用力即可把玻璃管插入橡皮管.甲同学将装置A的示意图画成图2,该示意图中明显的错误是没有(用酒精灯)加热.

已知:红磷与少量Cl2反应生成PCl3,与过量Cl2反应生成PCl5.PCl3遇O2会生成POCl3(三氯氧磷),POCl3溶于PCl3,PCl3遇水会强烈水解生成H3PO3和HCl.PCl3、POCl3的熔沸点见表.
| 物质 | 熔点/℃ | 沸点/℃ |
| PCl3 | -112 | 75.5 |
| POCl3 | 2 | 105.3 |
(1)B中所装试剂是浓硫酸,F中碱石灰的作用是吸收多余的Cl2,防止空气中的水蒸气进入烧瓶与PCl3反应.
(2)实验时,检查装置气密性后,向D装置的曲颈甑中加入红磷,打开K3通入干燥的CO2,一段时间后,关闭K3,加热曲颈甑至上部有黄色升华物出现时通入氯气,反应立即进行.通干燥CO2的作用是排尽装置中的空气,防止红磷自燃,
(3)实验制得的粗产品中常含有POCl3、PCl5等.加入红磷加热除去PCl5后,通过蒸馏(填实验操作名称),即可得到较纯净的PCl3.
(4)C装置中的K1、K2的设计也出于类似的目的,为了达到这一实验目的,实验时与K1、K2有关的操作是先关闭K1,打开K2,等B中溶液上方充满黄绿色气体后,打开K1,关闭K2.
(5)实验后期关闭K1,打开K2,将气体通入C装置中发生反应,反应后的溶液为X.某同学设计实验来确定溶液X中含有的某些离子,请补充完成实验步骤和现象.
| 实验步骤 | 实验现象 | 实验结论 |
| ① | 溶液X中含有Na+ | |
| ② | 溶液X中含有Cl- |
13.铁及其化合物在日常生活、生产中应用广泛.研究铁及其化合物的应用意义重大.
I.水体的净化和污水的处理与铁及其化合物密切相关.
(1)自来水厂常用高铁酸钠(Na2FeO4)改善水质.简述高铁酸钠用于杀菌消毒同时又起到净水作用的原理FeO42-有强的氧化性,能杀菌消毒,本身被还原为Fe3+,Fe3+发生水解生成氢氧化铁胶体吸附水中的杂质,达到净水的目的.
(2)碱式硫酸铁[Fe(OH)SO4]是一种用于污水处理的新型高效絮凝剂,在医药上也可用于治疗消化性溃疡出血.工业上利用废铁屑(含少量氧化铝、氧化铁等)生产碱式硫酸铁的工艺流程如图:
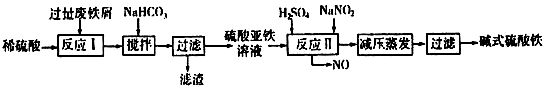
已知:部分阳离子以氢氧化物形式沉淀时溶液的pH见表:
回答下列问题:
①写出反应I中发生的氧化还原反应的离子方程式Fe+2H+═Fe2++H2↑.
②加入少量NaHCO3的目的是调节溶液pH,应控制pH的范围为4.4~7.5.
③在实际生产中,反应II常同时通入O2以减少NaNO2的用量,若通入5.6L O2(标准状况),则相当于节约NaNO2的质量为69g.
④碱式硫酸铁溶于水后产生的[Fe(OH)]2+离子,可部分水解生成[Fe2(OH)4]2+聚合离子.该水解反应的离子方程式为2[Fe(OH)]2++2H2O?[Fe2(OH)4]2++2H+;.
II.铁的化合物也是制备高能锂电池的重要原料.已知磷酸亚铁锂电池总反应为:
FePO4+Li$?_{充电}^{放电}$LiFePO4,电池中的固体电解质可传导Li+.试写出该电池充电时的阳极反应式LiFePO4-e-═FePO4+Li+.常温下以该电池为电源电解200mL饱和食盐水,当消耗1.4g Li时,溶液的pH为14.(忽略溶液的体积变化).
I.水体的净化和污水的处理与铁及其化合物密切相关.
(1)自来水厂常用高铁酸钠(Na2FeO4)改善水质.简述高铁酸钠用于杀菌消毒同时又起到净水作用的原理FeO42-有强的氧化性,能杀菌消毒,本身被还原为Fe3+,Fe3+发生水解生成氢氧化铁胶体吸附水中的杂质,达到净水的目的.
(2)碱式硫酸铁[Fe(OH)SO4]是一种用于污水处理的新型高效絮凝剂,在医药上也可用于治疗消化性溃疡出血.工业上利用废铁屑(含少量氧化铝、氧化铁等)生产碱式硫酸铁的工艺流程如图:

已知:部分阳离子以氢氧化物形式沉淀时溶液的pH见表:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
| 开始沉淀 | 2.3 | 7.5 | 3.4 |
| 完全沉淀 | 3.2 | 9.7 | 4.4 |
①写出反应I中发生的氧化还原反应的离子方程式Fe+2H+═Fe2++H2↑.
②加入少量NaHCO3的目的是调节溶液pH,应控制pH的范围为4.4~7.5.
③在实际生产中,反应II常同时通入O2以减少NaNO2的用量,若通入5.6L O2(标准状况),则相当于节约NaNO2的质量为69g.
④碱式硫酸铁溶于水后产生的[Fe(OH)]2+离子,可部分水解生成[Fe2(OH)4]2+聚合离子.该水解反应的离子方程式为2[Fe(OH)]2++2H2O?[Fe2(OH)4]2++2H+;.
II.铁的化合物也是制备高能锂电池的重要原料.已知磷酸亚铁锂电池总反应为:
FePO4+Li$?_{充电}^{放电}$LiFePO4,电池中的固体电解质可传导Li+.试写出该电池充电时的阳极反应式LiFePO4-e-═FePO4+Li+.常温下以该电池为电源电解200mL饱和食盐水,当消耗1.4g Li时,溶液的pH为14.(忽略溶液的体积变化).
12.下列物属于酸性氧化物的是( )
| A. | CO2 | B. | CaO | C. | H2O | D. | Na2O |
11.下列物质属于盐的是( )
| A. | Na2CO3 | B. | HCl | C. | H2O | D. | NaOH |
8.设NA代表阿伏加德罗常数,下列关于0.2mol/L的Ba(NO3)2溶液的说法中不正确的是( )
0 172612 172620 172626 172630 172636 172638 172642 172648 172650 172656 172662 172666 172668 172672 172678 172680 172686 172690 172692 172696 172698 172702 172704 172706 172707 172708 172710 172711 172712 172714 172716 172720 172722 172726 172728 172732 172738 172740 172746 172750 172752 172756 172762 172768 172770 172776 172780 172782 172788 172792 172798 172806 203614
| A. | 1L溶液中含有0.2NA个NO3- | |
| B. | 1L溶液中所含的阴、阳离子总数为0.6NA个 | |
| C. | 0.5L溶液中Ba2+浓度是0.1mol/L | |
| D. | 500mL溶液中,含有NO3-的物质的量为0.2mol |

