题目内容
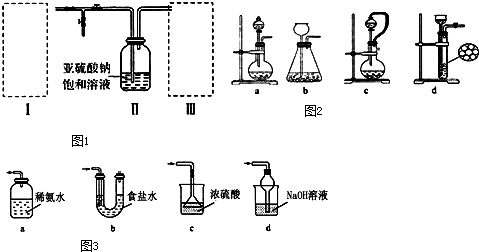
12.下列物属于酸性氧化物的是( )| A. | CO2 | B. | CaO | C. | H2O | D. | Na2O |
分析 氧化物只有两种元素,且必须有氧元素,酸性氧化物是与碱反应生成盐和水的氧化物,中心原子化合价不变,溶于水一般生成酸的氧化物.
解答 解:A.CO2是酸性氧化物,能与碱反应:CO2+2NaOH=Na2CO3+H2O,故A正确;
B.CaO虽然是氧化物,但CaO与酸发生反应生成盐和水,属于碱性氧化物,不是酸性氧化物,故B错误;
C.水属于氧化物,既和酸不反应,又和碱不反应,不属于酸性氧化物,故C错误;
D.Na2O虽然是氧化物,但和酸发生反应生成盐和水,属于碱性氧化物,不是酸性氧化物,故D错误;
故选A.
点评 本题主要考查氧化物的概念,解答时要分析物质的元素组成,然后再根据氧化物概念的含义进行分析、判断,从而得出正确的结论,题目难度不大.

练习册系列答案
相关题目
20.Fe元素是地壳中最丰富的元素之一,在金属中仅次于铝,铁及其化合物在生活、生产中有广泛应用.
(1)黄铁矿(FeS2)是生产硫酸和冶炼钢铁的重要原料.其中一个反应为:3FeS2+8O2$\frac{\underline{\;高温\;}}{\;}$6SO2+Fe304有3mol FeS2参加反应,转移32mol电子.
(2)自来水厂常用高铁酸钠(Na2Fe04)改善水质.简述高铁酸钠用于杀菌消毒同时又起到净水作用的原理FeO42-有强的氧化性,能杀菌消毒,本身被还原为Fe3+,Fe3+发生水解生成氢氧化铁胶体吸附水中的杂质,达到净水的目的
(3)氧化铁是重要工业颜料,工业上利用废铁屑(含少量氧化铝、氧化铁等)生产它的工艺流程如下:
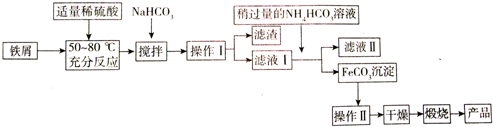
已知部分阳离子以氢氧化物形式沉淀的pH值见下表:
回答下列问题:
①操作I、Ⅱ的名称分别是过滤、洗涤
②铁屑与稀硫酸反应前,应用10% Na2CO3溶液浸泡几分钟,其目的是除去铁屑表面的油污
③铁屑与稀硫酸反应时,需加入过量铁屑的原因是(用离子反应方程式表示)Fe+2Fe3+=3Fe2+
④加入少量NaHCO3的目的是调节溶液pH,应控制pH的范围为4.4~7.5
⑤写出在空气中煅烧FeCO3的化学方程式4FeCO3+O2$\frac{\underline{\;高温\;}}{\;}$2Fe2O3+4CO2
⑥有些同学认为滤液Ⅰ中铁元素含量可用一定浓度的KMnO4溶液来测定,其设计的下列滴定方式中,最合理的是b.(夹持部分略去)(填字母序号)

(1)黄铁矿(FeS2)是生产硫酸和冶炼钢铁的重要原料.其中一个反应为:3FeS2+8O2$\frac{\underline{\;高温\;}}{\;}$6SO2+Fe304有3mol FeS2参加反应,转移32mol电子.
(2)自来水厂常用高铁酸钠(Na2Fe04)改善水质.简述高铁酸钠用于杀菌消毒同时又起到净水作用的原理FeO42-有强的氧化性,能杀菌消毒,本身被还原为Fe3+,Fe3+发生水解生成氢氧化铁胶体吸附水中的杂质,达到净水的目的
(3)氧化铁是重要工业颜料,工业上利用废铁屑(含少量氧化铝、氧化铁等)生产它的工艺流程如下:

已知部分阳离子以氢氧化物形式沉淀的pH值见下表:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
| 开始沉淀 | 2.3 | 7.5 | 3.4 |
| 沉淀完全 | 3.2 | 9.7 | 4.4 |
①操作I、Ⅱ的名称分别是过滤、洗涤
②铁屑与稀硫酸反应前,应用10% Na2CO3溶液浸泡几分钟,其目的是除去铁屑表面的油污
③铁屑与稀硫酸反应时,需加入过量铁屑的原因是(用离子反应方程式表示)Fe+2Fe3+=3Fe2+
④加入少量NaHCO3的目的是调节溶液pH,应控制pH的范围为4.4~7.5
⑤写出在空气中煅烧FeCO3的化学方程式4FeCO3+O2$\frac{\underline{\;高温\;}}{\;}$2Fe2O3+4CO2
⑥有些同学认为滤液Ⅰ中铁元素含量可用一定浓度的KMnO4溶液来测定,其设计的下列滴定方式中,最合理的是b.(夹持部分略去)(填字母序号)

1.已知:将Cl2通入适量KOH溶液,产物中可能有KCl、KClO和KClO3,且$\frac{c(C{l}^{-})}{c(Cl{O}^{-})}$的值与温度高低有关.当n(KOH)=amol时,下列有关说法错误的是( )
| A. | 若某温度下,反应后$\frac{c(C{l}^{-})}{c(Cl{O}^{-})}$=2,则溶液中$\frac{c(Cl{O}^{-})}{c(Cl{O}_{3}^{-})}$=0.2 | |
| B. | 参加反应的氯气的物质的量等于0.5a mol | |
| C. | 改变温度,反应中转移电子的物质的量ne的范围:$\frac{1}{2}$a mol≤ne≤$\frac{5}{6}$a mol | |
| D. | 改变温度,产物中KClO3的最大理论产量为$\frac{a}{6}$mol |
2.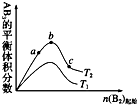 在其他条件不变时,改变某一条件对 A2(g)+3B2(g)?2AB3(g)化学平衡状态的影响,得到如图所示的变化规律(图中T表示温度),由此可得出的结论是( )
在其他条件不变时,改变某一条件对 A2(g)+3B2(g)?2AB3(g)化学平衡状态的影响,得到如图所示的变化规律(图中T表示温度),由此可得出的结论是( )
 在其他条件不变时,改变某一条件对 A2(g)+3B2(g)?2AB3(g)化学平衡状态的影响,得到如图所示的变化规律(图中T表示温度),由此可得出的结论是( )
在其他条件不变时,改变某一条件对 A2(g)+3B2(g)?2AB3(g)化学平衡状态的影响,得到如图所示的变化规律(图中T表示温度),由此可得出的结论是( )| A. | T1<T2,平衡常数 K1<K2 | |
| B. | 达到平衡时 A2 的转化率大小为 b>a>c | |
| C. | a、b、c 三点的平衡常数 Kb>Ka>Kc | |
| D. | 达到平衡时,AB3 的物质的量大小为 c>b>a |