8.甲醇是重要的化工原料,又可作为燃料.利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主反应如下:
①CO(g)+2H2(g)═CH3OH(g)△H1
②CO2(g)+3H2(g)═CH3OH(g)+H2O(g)△H2
③CO2(g)+H2(g)═CO(g)+H2O(g)△H3
回答下列问题:
(1)已知
则△H1=-99kJ.mol-1
(2)图1中能正确表现反应①的平衡常数K随温度变化关系的曲线为a(填曲线标记字母),判断理由是反应①正反应为放热反应,平衡常数随温度升高而减小.
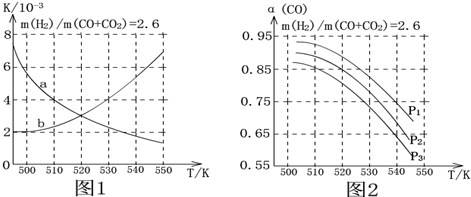
(3)合成气的组成n(H2)/n(CO+CO2)=2.60时体系中的CO平衡转化率(α)与温度和压强的关系如图2所示.α(CO)值随温度升高而减小(填“增大”或“减小”)原因是反应①正反应为放热反应,升高温度,平衡向逆反应方向移动,平衡体系中CO的量增大,反应③为吸热反应,升高温度,平衡向正反应方向移动,又使平衡体系中CO的增大,总结果,随温度升高,CO的转化率减小..图2中的压强由大到小为P1>P2>P3,判断理由是相同温度下,反应③前后气体分子数不变,压强改变不影响其平衡移动,反应①正反应为气体分子数减小的反应,增大压强,有利于平衡向正反应方向移动,CO的转化率增大,故增大压强有利于CO的转化率升高..
①CO(g)+2H2(g)═CH3OH(g)△H1
②CO2(g)+3H2(g)═CH3OH(g)+H2O(g)△H2
③CO2(g)+H2(g)═CO(g)+H2O(g)△H3
回答下列问题:
(1)已知
| 化学键 | H-H | C-O | C=O | H-O | C-H |
| E/(kJ.mol-1) | 436 | 343 | 1076 | 465 | 413 |
(2)图1中能正确表现反应①的平衡常数K随温度变化关系的曲线为a(填曲线标记字母),判断理由是反应①正反应为放热反应,平衡常数随温度升高而减小.

(3)合成气的组成n(H2)/n(CO+CO2)=2.60时体系中的CO平衡转化率(α)与温度和压强的关系如图2所示.α(CO)值随温度升高而减小(填“增大”或“减小”)原因是反应①正反应为放热反应,升高温度,平衡向逆反应方向移动,平衡体系中CO的量增大,反应③为吸热反应,升高温度,平衡向正反应方向移动,又使平衡体系中CO的增大,总结果,随温度升高,CO的转化率减小..图2中的压强由大到小为P1>P2>P3,判断理由是相同温度下,反应③前后气体分子数不变,压强改变不影响其平衡移动,反应①正反应为气体分子数减小的反应,增大压强,有利于平衡向正反应方向移动,CO的转化率增大,故增大压强有利于CO的转化率升高..
6. 下列两种方案制备氢氧化铝:
下列两种方案制备氢氧化铝:
方案一:2.7g Al $\stackrel{100mL稀盐酸}{→}$X溶液 $\stackrel{NaOH溶液}{→}$Al(OH)3沉淀
方案二:2.7g Al $\stackrel{100mLNaOH溶液}{→}$Y溶液$\stackrel{稀盐酸}{→}$Al(OH)3沉淀
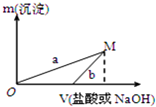
已知所用的稀盐酸与NaOH溶液均为3mol/L.图是向X溶液与Y溶液中分别加入NaOH溶液或稀盐酸时产生沉淀的质量与加入溶液体积之间的关系.相关说法正确的是( )
 下列两种方案制备氢氧化铝:
下列两种方案制备氢氧化铝:方案一:2.7g Al $\stackrel{100mL稀盐酸}{→}$X溶液 $\stackrel{NaOH溶液}{→}$Al(OH)3沉淀
方案二:2.7g Al $\stackrel{100mLNaOH溶液}{→}$Y溶液$\stackrel{稀盐酸}{→}$Al(OH)3沉淀
已知所用的稀盐酸与NaOH溶液均为3mol/L.图是向X溶液与Y溶液中分别加入NaOH溶液或稀盐酸时产生沉淀的质量与加入溶液体积之间的关系.相关说法正确的是( )
| A. | a曲线表示的是向Y溶液中加入NaOH溶液 | |
| B. | 方案二比方案一生成更多的气体 | |
| C. | 在M点时,两种方案中所得溶液的溶质质量分数相同 | |
| D. | M点以后,a、b两条曲线将重合为一条 |
5.下列除杂方法不合理的是( )
| A. | 通过饱和食盐水除去Cl2中的HCl | |
| B. | 通过NaOH溶液除去CO2中的HCl | |
| C. | 通过加热法除去Na2CO3固体中的NaHCO3 | |
| D. | 通过NaOH溶液除去CO中混有的CO2 |
4.适量CO2通入含0.8gNaOH的碱溶液中,将所得的溶液在减压、低温下蒸干 后得到1.0g固体物质,则该固体物质的成分是( )
| A. | Na2CO3 | B. | NaHCO3 | C. | Na2CO3、NaHCO3 | D. | Na2CO3、NaOH |
3.下列叙述中,正确的是( )
| A. | 强电解质的导电性一定比弱电解质的导电性强 | |
| B. | 溶解度小的物质的导电性一定比溶解度大的物质的导电性弱 | |
| C. | 金属元素从化合态变为游离态时,该元素一定被还原 | |
| D. | 金属阳离子得电子多时氧化性强 |
19. 探究Fe3+和Cu2+对H2O2分解的催化效果
探究Fe3+和Cu2+对H2O2分解的催化效果
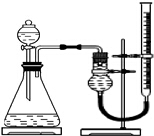
实验小组用如图所示装置,选取相关试剂,设计并进行以下实验.忽略其他因素的影响,实验中相关数据记录如下表:
(1)除上述装置中的仪器及量筒外,还要用到的计量工具是秒表.为确保实验的准确性,实验前需检查该装置的气密性,操作是关闭分液漏斗,打开止水夹,上下移动有刻度的玻璃管,有刻度的玻璃管中液面高度变化,若干燥管中的液面与玻璃管中液面高度不一致,并保持一定的高度差,则气密性良好.
(2)实验①④的主要目的是证明硫酸根离子对H2O2分解无催化效果.
(3)实验②中选用试剂的体积v1=5mL.
(4)实验③中选用的试剂M是Fe2(SO4)3;若正确选用试剂进行实验,测得收集V mL O2所需时间m>n>p,由此得出的实验结论是Fe3+对H2O2分解的催化效果比Cu2+对H2O2分解的催化效果更好.
0 172600 172608 172614 172618 172624 172626 172630 172636 172638 172644 172650 172654 172656 172660 172666 172668 172674 172678 172680 172684 172686 172690 172692 172694 172695 172696 172698 172699 172700 172702 172704 172708 172710 172714 172716 172720 172726 172728 172734 172738 172740 172744 172750 172756 172758 172764 172768 172770 172776 172780 172786 172794 203614
 探究Fe3+和Cu2+对H2O2分解的催化效果
探究Fe3+和Cu2+对H2O2分解的催化效果实验小组用如图所示装置,选取相关试剂,设计并进行以下实验.忽略其他因素的影响,实验中相关数据记录如下表:
| 实验序号 | 5% H2O2溶液的体积(mL) | 选用试剂 | 选用试剂体积(mL) | 收集V mL O2所需时间(min) |
| ① | 10 | 蒸馏水 | 5 | m |
| ② | 10 | 0.1mol/L CuSO4 | v1 | n |
| ③ | 10 | 试剂M | 5 | p |
| ④ | 10 | 0.1mol/L Na2SO4 | 5 | m |
(2)实验①④的主要目的是证明硫酸根离子对H2O2分解无催化效果.
(3)实验②中选用试剂的体积v1=5mL.
(4)实验③中选用的试剂M是Fe2(SO4)3;若正确选用试剂进行实验,测得收集V mL O2所需时间m>n>p,由此得出的实验结论是Fe3+对H2O2分解的催化效果比Cu2+对H2O2分解的催化效果更好.
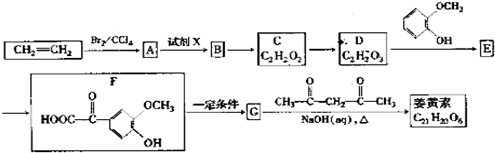

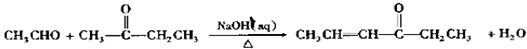

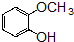 +OHCCOOH→
+OHCCOOH→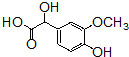 ,其反应类型是加成反应.
,其反应类型是加成反应.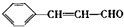 ),写出制备肉桂醛所需有机物的结构简式C6H5CHO、CH3CHO.
),写出制备肉桂醛所需有机物的结构简式C6H5CHO、CH3CHO.
 某浅绿色晶体X[x(NH4)2SO4•yFeSO4•zH2O]在分析化学上常用作还原剂.为确定其组成,某小组同学进行如下实验.
某浅绿色晶体X[x(NH4)2SO4•yFeSO4•zH2O]在分析化学上常用作还原剂.为确定其组成,某小组同学进行如下实验.