3.以水为分散剂的分散系,按稳定性由强到弱的顺序排列的是( )
| A. | 溶液、胶体、浊液 | B. | 浊液、胶体、溶液 | C. | 胶体、浊液、溶液 | D. | 浊液、溶液、胶体 |
2.下列离子方程式正确的是( )
| A. | Fe(OH)3溶于氢碘酸:Fe(OH)3+3H+═Fe3++3H2O | |
| B. | 次氯酸钠溶液中通入二氧化硫气体:2ClO-+SO2+H2O═2HClO+SO32- | |
| C. | 次氯酸钙溶液中通入过量的二氧化碳:Ca2++2ClO-+H2O+CO2═CaCO3↓+2HClO | |
| D. | 少量NaHSO4与过量Ba(OH)2溶液反应:H++SO42-+Ba2++OH-═BaSO4↓+H2O |
20.为了验证NaHCO3固体中是否含有Na2CO3,下列实验及判断中,正确的是( )
| A. | 加热,观察是否有气体放出 | |
| B. | 加入盐酸,观察是否有气体放出 | |
| C. | 溶于水后加BaCl2溶液,观察有无沉淀出现 | |
| D. | 进行焰色反应,观察火焰是否呈黄色 |
19.在某无色透明的溶液中,能大量共存的离子组是( )
| A. | H+、Na+、SO42-、HCO3-? | B. | Mg2+、K+、SO42-、OH- | ||
| C. | K+、Na+、Fe3+、NO3- | D. | Ba2+、OH-、NO3-、Na+ |
18. 已知在25℃时,醋酸、碳酸和亚硫酸的电离平衡常数如下表:
已知在25℃时,醋酸、碳酸和亚硫酸的电离平衡常数如下表:
(1)写出碳酸的第一步电离平衡常数表达式:Ka1=$\frac{c({H}^{+})•c(HC{{O}_{3}}^{-})}{c({H}_{2}C{O}_{3})}$.
(2)在相同条件下,试比较H2CO3、HCO3-和HSO3-的酸性强弱:H2CO3>HSO3->HCO3-.
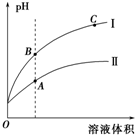
(3)如图表示常温时稀释醋酸、碳酸两种酸的稀溶液时,溶液PH随水量的变化图象中,曲线I表示的酸是CH3COOH(填化学式).
②a、b、c三点中,水的电离程度最大的是C(填字母).
 已知在25℃时,醋酸、碳酸和亚硫酸的电离平衡常数如下表:
已知在25℃时,醋酸、碳酸和亚硫酸的电离平衡常数如下表:| 醋酸 | 碳酸 | 亚硫酸 |
| Ka=1.75×10-5 | Ka1=4.30×10-7 Ka2=5.61×10-11 | Ka1=1.54×10-2 Ka2=1.02×10-7 |
(2)在相同条件下,试比较H2CO3、HCO3-和HSO3-的酸性强弱:H2CO3>HSO3->HCO3-.
(3)如图表示常温时稀释醋酸、碳酸两种酸的稀溶液时,溶液PH随水量的变化图象中,曲线I表示的酸是CH3COOH(填化学式).
②a、b、c三点中,水的电离程度最大的是C(填字母).
17.下列说法不正确的是( )
0 172532 172540 172546 172550 172556 172558 172562 172568 172570 172576 172582 172586 172588 172592 172598 172600 172606 172610 172612 172616 172618 172622 172624 172626 172627 172628 172630 172631 172632 172634 172636 172640 172642 172646 172648 172652 172658 172660 172666 172670 172672 172676 172682 172688 172690 172696 172700 172702 172708 172712 172718 172726 203614
| A. | 化学反应过程中既有物质变化又有能量变化,能量的释放或吸收以物质变化为基础 | |
| B. | 研究化学反应进行的方向、快慢和限度是化学反应原理的重要内容 | |
| C. | 电解质在水溶液中的反应反应速率很高,是因为这类反应不需要活化能来引发 | |
| D. | 大力发展火电以满足工业发展对电力的需求,符合节能减排的要求 |
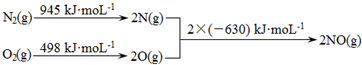
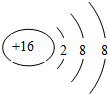 .
.