题目内容
18. 已知在25℃时,醋酸、碳酸和亚硫酸的电离平衡常数如下表:
已知在25℃时,醋酸、碳酸和亚硫酸的电离平衡常数如下表:| 醋酸 | 碳酸 | 亚硫酸 |
| Ka=1.75×10-5 | Ka1=4.30×10-7 Ka2=5.61×10-11 | Ka1=1.54×10-2 Ka2=1.02×10-7 |
(2)在相同条件下,试比较H2CO3、HCO3-和HSO3-的酸性强弱:H2CO3>HSO3->HCO3-.
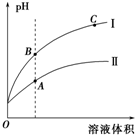
(3)如图表示常温时稀释醋酸、碳酸两种酸的稀溶液时,溶液PH随水量的变化图象中,曲线I表示的酸是CH3COOH(填化学式).
②a、b、c三点中,水的电离程度最大的是C(填字母).
分析 (1)碳酸的第一级电离方程式为H2CO3?H++HCO3-,电离平衡常数为生成物浓度幂之比与反应物浓度幂之积的比值;根据电离平衡移动原理分析;
(2)根据H2CO3、HCO3-和HSO3-的电离平衡常数确定酸性的强弱;
(3)酸的酸性越强,加水稀释时pH变化越大;酸溶液中,氢离子浓度越大,水的电离程度越小.
解答 解:(1)碳酸的第一级电离方程式为H2CO3?H++HCO3-,电离平衡常数为生成物浓度幂之比与反应物浓度幂之积的比值,则K1=$\frac{c({H}^{+})•c(HC{{O}_{3}}^{-})}{c({H}_{2}C{O}_{3})}$,碳酸的第二步电离由于第一步电离产生的氢离子对第二步有抑制作用,所以比第一步困难,
故答案为:$\frac{c({H}^{+})•c(HC{{O}_{3}}^{-})}{c({H}_{2}C{O}_{3})}$;
(2)H2CO3、HCO3-和HSO3-的电离平衡常数分别是:4.30×10-7、5.61×10-11、1.02×10-7,所以酸性顺序是:H2CO3>HSO3->HCO3-,
故答案为:H2CO3;HSO3-;HCO3-;
(3)酸的酸性越强,加水稀释时pH变化越大,醋酸的酸性比碳酸强,所以曲线I表示的酸是CH3COOH;酸溶液中,氢离子浓度越大即pH越大,水的电离程度越小,所以ABC三点水的电离程度最大的是C点,
故答案为:CH3COOH;C.
点评 本题考查了弱电解质的电离平衡常数表达式书写、据电离平衡常数分析弱酸的酸性强弱、影响弱电解质电离平衡移动的因素,题目难度不大.

练习册系列答案
相关题目
5.某校化学课外小组同学组装了下列仪器,欲经过简单连接,制备中学化学的几种常见气体.
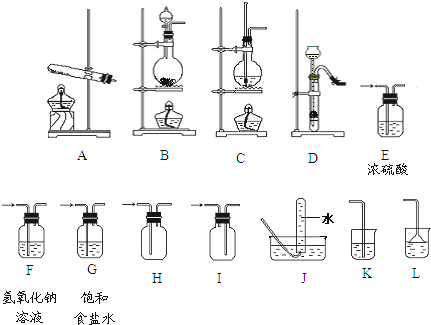
请填写下列表格中的空白处:

请填写下列表格中的空白处:
| 序号 | 气体 | 装置的连接顺序(用符号表示) | 按要求填试剂 名称 | 实验室制取该气体 的反应方程式 (是离子反应的写离子反应方程式) |
| (1) | CO2 | 制备→收集 | ||
| (2) | NH3 | 制备→收集 →尾气处理 | 若干燥气体可选用的试剂 碱石灰 | |
| (3) | Cl2 | 制备→净化→干燥→收集→尾气处理 | 处理尾气 的试剂 氢氧化钠溶液 | |
| (4) | 制备→净化→收集 C→F→J |
9.水煤气 (主要成分:CO、H2 ) 是重要燃料和化工原料,可用水蒸气通过炽热的炭层制得:
C (s)+H2O(g)?CO (g)+H2 (g);△H=+131.3kJ•mol-1
(1)某温度下,四个容器中均进行着上述反应,各容器中炭足量,其它物质的物质的量浓度及正逆反应速率关系如下表所示.请填写表中相应的空格.
(2)另有一个容积可变的密闭容器.恒温恒压下,向其中加入1.0mol炭和 1.0mo l水蒸气 (H216O),发生上述反应,达到平衡时,容器的体积变为原来的1.25 倍.平衡时水蒸气的转化率为25%;向该容器中补充 a mol 炭,水蒸气的转化率将不变(填“增大”、“减小”、“不变”),再补充 a mol 水蒸气 (H218O),最终容器中C16O和C18O 的物质的量之比为1:a.
(3)己知:C (s)+$\frac{1}{2}$O2(g)═CO (g);△H=-110.5kJ•mo1-1
CO(g)+$\frac{1}{2}$O2(g)═CO2 (g);△H=-283.0kJ•mo1-1
H2 (g)+$\frac{1}{2}$O2 (g)═H2O (g);△H=-241.8kJ•mo1-1
那么,将2.4g 炭完全转化为水煤气,然后再燃烧,整个过程△H=-78.7kJ•mo1-1.
C (s)+H2O(g)?CO (g)+H2 (g);△H=+131.3kJ•mol-1
(1)某温度下,四个容器中均进行着上述反应,各容器中炭足量,其它物质的物质的量浓度及正逆反应速率关系如下表所示.请填写表中相应的空格.
| 容器编号 | c(H2O)/mol•L-1 | c(CO)/mol•L-1 | c(H2)/mol•L-1 | V正、V逆比较 |
| Ⅰ | 0.06 | 0.60 | 0.10 | V正=V逆 |
| Ⅱ | 0.06 | 0.50 | 0.40 | ? |
| Ⅲ | 0.12 | 0.40 | 0.80 | V正<V逆 |
| Ⅳ | 0.12 | 0.30 | ? | V正=V逆 |
(3)己知:C (s)+$\frac{1}{2}$O2(g)═CO (g);△H=-110.5kJ•mo1-1
CO(g)+$\frac{1}{2}$O2(g)═CO2 (g);△H=-283.0kJ•mo1-1
H2 (g)+$\frac{1}{2}$O2 (g)═H2O (g);△H=-241.8kJ•mo1-1
那么,将2.4g 炭完全转化为水煤气,然后再燃烧,整个过程△H=-78.7kJ•mo1-1.
13.在密闭容器中,反应2HI?H2+I2△H>0,当达到平衡时,欲使混合气体颜色加深,可采取的措施有( )
| A. | 减小容器体积 | B. | 降低温度 | ||
| C. | 加入催化剂 | D. | 恒容下充入HI气体 |
3.以水为分散剂的分散系,按稳定性由强到弱的顺序排列的是( )
| A. | 溶液、胶体、浊液 | B. | 浊液、胶体、溶液 | C. | 胶体、浊液、溶液 | D. | 浊液、溶液、胶体 |
10.苯作萃取剂,并用分液漏斗萃取溴水中的溴单质的实验,下列说法正确的是( )
| A. | 不能使用酒精作为萃取剂,因为溴单质在酒精中的溶解度比在水中的小 | |
| B. | 静置分层后有色层在下层,水层几乎无色 | |
| C. | 分液漏斗使用前应当用蒸馏水检验是否漏液 | |
| D. | 振荡、静置分层后,依次用两个不同的烧杯从下口分别接取上下两层液体 |
7.下列叙述中,错误的是( )
| A. | 新制氯水可使紫色石蕊试液先变红后褪色 | |
| B. | 实验室制取氯气时,常用饱和石灰水来吸收多余的氯气 | |
| C. | 漂白粉在漂白时产生次氯酸,所以漂白粉能使燃料等有机色素褪色 | |
| D. | 钾元素颜色反应的操作是:将铂丝放在稀盐酸中洗涤后灼烧置无色,然后再用铂丝蘸取固体氯化钾,置于煤气灯的火焰上进行灼烧,透过蓝色钴玻璃进行观察 |
8.设NA是阿伏伽德罗常数的数值,下列说法正确的是( )
| A. | 1molAl3+离子含有的电子数为3NA | |
| B. | 1molCl2含有1 NA个原子 | |
| C. | 23g钠在22.4L(标况下)Cl2中反应,转移电子数NA个 | |
| D. | 欲配制1.00L 1.00mol.L-1的NaCl溶液,可将 58.5gNaCl溶于 1.00L水中 |
