10.下列实验操作错误的是( )
| A. | 蒸馏时,应使温度计水银球靠近蒸馏烧瓶支管口 | |
| B. | 在分液漏斗中用酒精萃取碘水中的碘,分液时下层液体从下口放出,上层液体从上口倒出 | |
| C. | 配制浓H2SO4和浓HNO3的混酸时,应将浓H2SO4慢慢加到浓HNO3中,并及时搅拌 | |
| D. | 用蒸发结晶的方法可使NaCl从溶液中析出 |
9.NA代表阿伏加德罗常数,下列说法正确的是( )
| A. | 在同温同压下,相同体积的任何气体单质所含的原子数相等 | |
| B. | 1 mol某气体的体积为22.4L,该气体所处的状态一定是标准状况 | |
| C. | 在常温常压下,11.2LN2所含原子数为NA | |
| D. | 标准状况下,22.4LN2和O2混合物所含的分子数为NA |
8.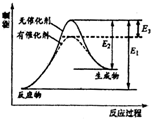 某反应的反应过程能量变化如图所示,E1表示正反应的活化能,E2表示逆反应的活化能,下列说法正确的是( )
某反应的反应过程能量变化如图所示,E1表示正反应的活化能,E2表示逆反应的活化能,下列说法正确的是( )
 某反应的反应过程能量变化如图所示,E1表示正反应的活化能,E2表示逆反应的活化能,下列说法正确的是( )
某反应的反应过程能量变化如图所示,E1表示正反应的活化能,E2表示逆反应的活化能,下列说法正确的是( )| A. | 该反应为放热反应 | B. | 该反应的焓变△H=E3 | ||
| C. | 催化剂不能降低反应的活化能 | D. | 该反应逆反应的焓变△H=E2-E1 |
7.实验室中,要使明矾溶液中的Al3+全部沉淀出 来,适宜用的试剂是( )
| A. | NaOH溶液 | B. | 氨水 | C. | 盐酸 | D. | Ba(OH)2溶液 |
6.下列无水氯化物中不能用氯气和该元素的单质直接化合制取的是( )
| A. | AlCl3 | B. | CuCl2 | C. | FeCl2 | D. | HCl |
5.已知反应:6KOH+3Cl2=KClO3+5KCl+3H2O,据此判断下列说法不正确的是( )
| A. | Cl2是氧化剂,KOH是还原剂 | |
| B. | KClO3是氧化产物,KCl是还原产物 | |
| C. | 该反应中氯气既体现了氧化性又体现了还原性 | |
| D. | 若生成1mol KClO3,则反应中转移10mol e- |
4.用NA表示阿伏加德罗常数的值,下列说法中正确的是( )
| A. | 32g氧气所含有的原子数目为NA | |
| B. | 标准状况下,22.4L水中含有个水分子NA | |
| C. | 常温常压下,4g氦气所含原子数目为NA | |
| D. | 标准状况下,22.4L氯化氢所含的原子数为NA |
3.将4gNaOH溶解在10ml水中,再稀释成1L的溶液,从中取出10ml,这10ml溶液的物质的量浓度是( )
| A. | 1 mol/L | B. | 0.1mol/L | C. | 0.001mol/L | D. | 10mol/L |
2.工业制硫酸时,利用催化氧化反应将SO2转化为SO3是一个关键的步骤.其反应为:SO2(g)+$\frac{1}{2}$O2(g)?SO3(g)△H=-98kJ•mol-1.一定温度时,向容积为2L的恒容密闭容器中充入一定量的SO2和O2,一段时间后达到平衡,反应过程中测定的部分数据见表
(1)保持温度不变,向平衡后的容器中再充入1mol SO2和0.5mol O2,再次答平衡后,0.2mol/L<c(O2)<0.3mol/L
(2)保持其他条件不变,若起始时向容器中充入2mol SO3,达到平衡时吸收78.4kJ的热量.
| 反应时间/min | n(SO2)/mol | n(O2)/mol |
| 0 | 2 | 1 |
| 5 | 1.2 | |
| 10 | 0.4 | |
| 15 | 0.8 |
(2)保持其他条件不变,若起始时向容器中充入2mol SO3,达到平衡时吸收78.4kJ的热量.
1.下列措施,对增大反应速率明显有效的是( )
0 172507 172515 172521 172525 172531 172533 172537 172543 172545 172551 172557 172561 172563 172567 172573 172575 172581 172585 172587 172591 172593 172597 172599 172601 172602 172603 172605 172606 172607 172609 172611 172615 172617 172621 172623 172627 172633 172635 172641 172645 172647 172651 172657 172663 172665 172671 172675 172677 172683 172687 172693 172701 203614
| A. | Na与水反应时增大水的用量 | |
| B. | Al在氧气中燃烧生成Al2O3,将铝片改成铝粉 | |
| C. | 在K2SO4与BaCl2两溶液反应时,增大压强 | |
| D. | Fe与硫酸反应制取H2时,选用浓硫酸 |