题目内容
6.下列无水氯化物中不能用氯气和该元素的单质直接化合制取的是( )| A. | AlCl3 | B. | CuCl2 | C. | FeCl2 | D. | HCl |
分析 根据Cl2有强氧化性,当与变价金属反应时将金属氧化成高价态来回答.
解答 解:A、因Cl2有强氧化性,与金属反应化合生成相应的盐(氯化物),当与金属Al反应时将金属氧化成氯化铝,能用氯气与单质直接化合制取,故A不符合;
B、因Cl2有强氧化性,与金属反应化合生成相应的盐(氯化物),当与金属Cu反应时将金属氧化成氯化成高价Cu即氯化铜,能用氯气与单质直接化合制取,故B不符合;
C、当氯气与变价金属Fe反应会生成FeCl3,不能用氯气与单质直接化合制取,故C符合;
D、氢气可以在氯气中燃烧生成氯化氢,能用氯气与单质直接化合制取,故C不符合;
故选C.
点评 本题考查了氯气的性质应用,Cl2是卤族元素的代表,有强氧化性,当与变价金属反应时将金属氧化成高价态.

练习册系列答案
 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案
相关题目
17.进行过滤操作应选用的一组仪器是( )
| A. | 烧杯、酒精灯、试管、铁架台(铁圈)、漏斗 | |
| B. | 烧杯、漏斗、玻璃棒、铁架台(铁圈)、滤纸 | |
| C. | 滤纸、烧杯、试管夹、漏斗、玻璃棒 | |
| D. | 滤纸、试管、漏斗、铁架台(铁圈)、玻璃棒 |
14.在浓度均为0.1mol/L的Na2CO3和NaHCO3的混合溶液中,下列关系正确的是( )
| A. | c(Na+)>c(CO32-)>c(HCO3-)>c(OH-)>c(H+) | |
| B. | c(Na+)-[c(CO32-)+c(HCO3-)]=c(OH-)-c(H+) | |
| C. | c(Na+):[c(CO32-)+c(HCO3-)+c(H2CO3)]=2:3 | |
| D. | c(HCO3-)+2c(H+)+3c(H2CO3)=c(CO32-)+2c(OH-) |
1.下列措施,对增大反应速率明显有效的是( )
| A. | Na与水反应时增大水的用量 | |
| B. | Al在氧气中燃烧生成Al2O3,将铝片改成铝粉 | |
| C. | 在K2SO4与BaCl2两溶液反应时,增大压强 | |
| D. | Fe与硫酸反应制取H2时,选用浓硫酸 |
11.下列说法中正确的是( )
| A. | 将342g 蔗糖(C12H22O11)溶于1L水中,所得溶液的物质的量浓度为1mol/L | |
| B. | 将1L2mol/L H2SO4溶液加水稀释到2L,所得溶液的物质的量浓度为1mol/L | |
| C. | 将1L 8.4 mol/L的H2SO4溶液加入到1L水中,所得溶液的物质的量浓度为9.2mol/L | |
| D. | 将336mL HCl气体溶于水,配成300 mL溶液,所得溶液的物质的量浓度为0.05mol/L |
18.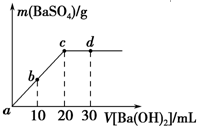 常温下,向0.25mol•L-1的硫酸溶液中逐滴加入物质的量浓度相同的氢氧化钡溶液,生成沉淀的量与加入氢氧化钡溶液的体积关系如图所示,a、b、c、d分别表示实验不同时刻的溶液,下列有关说法中不正确的是( )
常温下,向0.25mol•L-1的硫酸溶液中逐滴加入物质的量浓度相同的氢氧化钡溶液,生成沉淀的量与加入氢氧化钡溶液的体积关系如图所示,a、b、c、d分别表示实验不同时刻的溶液,下列有关说法中不正确的是( )
 常温下,向0.25mol•L-1的硫酸溶液中逐滴加入物质的量浓度相同的氢氧化钡溶液,生成沉淀的量与加入氢氧化钡溶液的体积关系如图所示,a、b、c、d分别表示实验不同时刻的溶液,下列有关说法中不正确的是( )
常温下,向0.25mol•L-1的硫酸溶液中逐滴加入物质的量浓度相同的氢氧化钡溶液,生成沉淀的量与加入氢氧化钡溶液的体积关系如图所示,a、b、c、d分别表示实验不同时刻的溶液,下列有关说法中不正确的是( )| A. | 硫酸溶液的体积为20mL | |
| B. | b时刻溶液中SO${\;}_{4}^{2-}$的浓度约为0.083mol•L-1 | |
| C. | d时刻溶液的pH为12 | |
| D. | 反应的离子反应方程式为Ba2++SO4-+2H++2OH-═BaSO4↓+2H2O |
15.下列各组离子在透明溶液中能大量共存的是( )
| A. | K+、Cu2+、Na+、Cl- | B. | H+、Na+、NO3-、CO32- | ||
| C. | Ba2+、H+、NO3-、SO42- | D. | Mg2+、Na+、OH-、SO42- |


