题目内容
1.下列措施,对增大反应速率明显有效的是( )| A. | Na与水反应时增大水的用量 | |
| B. | Al在氧气中燃烧生成Al2O3,将铝片改成铝粉 | |
| C. | 在K2SO4与BaCl2两溶液反应时,增大压强 | |
| D. | Fe与硫酸反应制取H2时,选用浓硫酸 |
分析 A.钠与水反应剧烈,加水不能改变浓度;
B.增大固体的接触面积,能够加快反应速率;
C.压强只对气体的反应速率有影响;
D.浓硫酸具有强氧化性,使铁发生钝化.
解答 解:A.加水不能改变浓度水的浓度,对反应速率没有影响,故A错误;
B.将Al片改成Al粉,增大了反应物的接触面积,所以能使反应速率加快,故B正确;
C.压强只对气体的反应速率有影响,对非气体的反应没有影响,增大压强速率不变,故C错误;
D.浓硫酸具有强氧化性,与铁发生钝化反应,没有氢气生成,不能提高生成气体的反应速率,故D错误;
故选B.
点评 本题考查化学反应速率的影响因素,为高频考点,侧重于学生的分析能力的考查,题目难度不大,注意浓硫酸与稀硫酸的性质的不同,为本题的易错点.

练习册系列答案
相关题目
12.下列有机物中,不溶于水的是( )
| A. | 酒精 | B. | 醋酸 | C. | 乙醚 | D. | 乙酸乙酯 |
6.下列无水氯化物中不能用氯气和该元素的单质直接化合制取的是( )
| A. | AlCl3 | B. | CuCl2 | C. | FeCl2 | D. | HCl |
13.下列说法正确的是( )
| A. | pH=6的溶液一定是酸性溶液 | |
| B. | 在等温等压条件下,能自发进行的化学反应,不一定是△H<0、△S>0 | |
| C. | 吸热反应一定需要加热才能发生,放热反应都能自发进行 | |
| D. | 弱电解质的电离常数既与弱电解质的性质和温度有关,也与溶液中的离子浓度有关 |
10.下列说法正确的是( )
| A. | 选择萃取剂将碘从碘水中萃取出来,这种萃取剂应具备的性质是不溶于水,且比水的密度大 | |
| B. | 选择萃取剂将碘从碘水中萃取出来,这种萃取剂应具备的性质是不溶于水,且比水的密度小 | |
| C. | 在使用分液漏斗进行分液时,上层液体经漏斗下口放出 | |
| D. | 选择萃取剂将碘从碘水中萃取出来,碘在四氯化碳中的溶解度比在水中的溶解度大 |
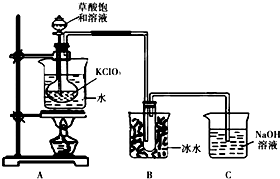 ClO2作为消毒剂在消毒过程中对人体无毒无害,具有广泛的应用前景.某同学用下图所示的装置制备ClO2气体,反应原理为饱和草酸溶液与KClO3粉末在60℃时反应制得ClO2(温度过高或过低都会影响制气效率)
ClO2作为消毒剂在消毒过程中对人体无毒无害,具有广泛的应用前景.某同学用下图所示的装置制备ClO2气体,反应原理为饱和草酸溶液与KClO3粉末在60℃时反应制得ClO2(温度过高或过低都会影响制气效率)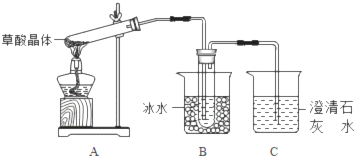
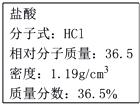 学会配制一定物质的量浓度的溶液具有重要意义.某同学欲用下图试剂瓶标签上某浓度的盐酸配制450mL 0.4mol/L的稀盐酸.
学会配制一定物质的量浓度的溶液具有重要意义.某同学欲用下图试剂瓶标签上某浓度的盐酸配制450mL 0.4mol/L的稀盐酸.