12.将4mol A(g)和2mol B(g)在2L的恒容密闭容器中混合并在一定条件下发生如下反应:2A(g)+B(g)?2C(g);△H<0,经2秒后测得C的浓度为0.6mol•L-1,下列说法正确的是( )
| A. | 2s时物质A的转化率为70% | |
| B. | 达到平衡状态时,升高温度,则该化学平衡向左移动,同时化学平衡常数K也减小 | |
| C. | 达到平衡状态时,增加A物质的量,A和B转化率都提高 | |
| D. | 当各物质浓度满足c(A)=2c(B)=c(C)时,该反应达到了平衡状态 |
11.下列说法正确的是( )
| A. | 7.1g氯气与足量的氢氧化钠溶液反应转移的电子束为0.2×6.02×1023 | |
| B. | VLamol•L-1的氯化铁溶液中,若Fe3+的数目为6.02×1023,则Cl-的数目大于3×6.02×1023 | |
| C. | 标准状况下,22.4LNO和11.2LO2混合后气体的分子总数为1.0×6.02×1023 | |
| D. | 工业用电解法进行粗铜精炼时,每转移1mol电子,阳极上溶解的铜原子数为0.5×6.02×1023 |
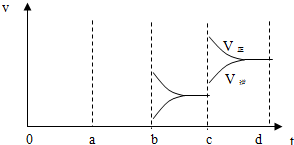
8.在一密闭容器中,反应 aA(气)?bB(气)达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,B的浓度是原来的40%,则( )
| A. | 平衡常数减小 | B. | 物质A的转化率增加了 | ||
| C. | 平衡向正反应方向移动了 | D. | a>b |
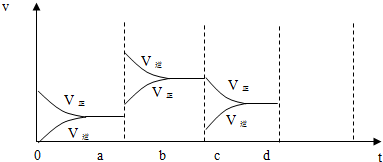
7.m A(g)+n B(g)?p c(g),在同一压强下变化如图,叙述正确的是( )


| A. | T1>T2,正反应是吸热反应 | B. | T1<T2,正反应是放热反应 | ||
| C. | T1<T2,正反应是吸热反应 | D. | T1>T2,正反应是放热反应 |
6.下列事实不能用勒夏特列原理解释的是( )
| A. | 工业生产硫酸的过程中使用过量的氧气,以提高二氧化硫的转化率 | |
| B. | 使用催化剂能加快化学反应速率,提高产率 | |
| C. | 用氨的催化氧化法生产硝酸使用过量空气以提高氨气的利用率 | |
| D. | 实验室用排饱和食盐水法收集氯气 |
5.在一定温度下,向a L密闭容器中加入1mol X气体和2mol Y气体,发生如下反应:X(g)+2Y(g)?3Z(g)此反应达到平衡的标志是( )
| A. | 容器内压强不随时间变化而变化 | |
| B. | 单位时间消耗0.1mol X同时生成0.3mol Z | |
| C. | 容器内X、Y、Z的浓度之比为1:2:3 | |
| D. | 容器内各物质的浓度不随时间变化而变化 |
4.2015年6月5日中国环境日主题是“践行绿色生活”,该主题旨在增强全民环境意识、节约意识、生态意识,选择低碳、节俭的绿色生活方式和消费模式,下列有关说法不正确的是( )
0 172486 172494 172500 172504 172510 172512 172516 172522 172524 172530 172536 172540 172542 172546 172552 172554 172560 172564 172566 172570 172572 172576 172578 172580 172581 172582 172584 172585 172586 172588 172590 172594 172596 172600 172602 172606 172612 172614 172620 172624 172626 172630 172636 172642 172644 172650 172654 172656 172662 172666 172672 172680 203614
| A. | 开发废旧电池综合利用技术,防止其中重金属盐对土壤水资源造成污染 | |
| B. | 绿色化学的核心是应用化学原理对环境污染进行治理 | |
| C. | 低碳生活就是节能减排,使用太阳能等代替化石燃料,可减少温室气体的排放 | |
| D. | 光导纤维是以二氧化硅为主要原料制成的 |
 .
.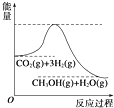 (1)盖斯定律的含义是:对于一个化学反应,无论是一步完成还是分几步完成,其反应焓变都是相同的,换句话说:化学反应的反应热只与体系的始态和终态有关,而与反应的途径无关
(1)盖斯定律的含义是:对于一个化学反应,无论是一步完成还是分几步完成,其反应焓变都是相同的,换句话说:化学反应的反应热只与体系的始态和终态有关,而与反应的途径无关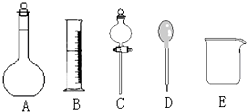 我校环保兴趣小组在处理污水样品时,需用质量分数为36.5%的浓盐酸(密度为1.19g/cm3)配制成240mL 0.1mol•L-1的盐酸溶液.
我校环保兴趣小组在处理污水样品时,需用质量分数为36.5%的浓盐酸(密度为1.19g/cm3)配制成240mL 0.1mol•L-1的盐酸溶液.