题目内容
12.将4mol A(g)和2mol B(g)在2L的恒容密闭容器中混合并在一定条件下发生如下反应:2A(g)+B(g)?2C(g);△H<0,经2秒后测得C的浓度为0.6mol•L-1,下列说法正确的是( )| A. | 2s时物质A的转化率为70% | |
| B. | 达到平衡状态时,升高温度,则该化学平衡向左移动,同时化学平衡常数K也减小 | |
| C. | 达到平衡状态时,增加A物质的量,A和B转化率都提高 | |
| D. | 当各物质浓度满足c(A)=2c(B)=c(C)时,该反应达到了平衡状态 |
分析 A、根据转化率=$\frac{转化量}{起始量}$×100%计算;
B、升高温度平衡向吸热方向移动,从而确定化学平衡常数K变化;
C、增加A物质的量,B转化率提高,则A的转化率降低;
D、当同一物质的正逆反应速率相等时,该反应达到平衡状态.
解答 解:A、因为经2秒后测得C的浓度为0.6mol•L-1,所以生成C的物质的量为0.6×2=1.2mol,又2A(g)+B(g)?2C(g),所以消耗A为1.2mol,则转化率=$\frac{转化量}{起始量}$×100%=$\frac{1.2}{4}$×100%=30%,故A错误;
B、升高温度平衡向吸热方向移动即逆反应方向移动,所以平衡常数K减小,故B正确;
C、增加A物质的量,B转化率提高,则A的转化率降低,故C错误;
D、反应过程中,当c(A)=2c(B)=c(C)时,反应不一定达到平衡状态,这与反应物的浓度及其转化率有关,故D错误;
故选B.
点评 本题考查了化学平衡状态的判断及外界条件对化学平衡的影响,难度不大,注意反应达到平衡状态时,正逆反应速率相等但不等于0,平衡常数随温度变化.

练习册系列答案
相关题目
3.设NA表示阿伏伽德罗常数的值,下列说法正确的是( )
| A. | 71gCl2中含氯原子数为2NA | |
| B. | 1molO3中含原子数为2NA | |
| C. | 1mol/L K2SO4溶液中含K+数为NA | |
| D. | 标准状况下,22.4LH2O中含水分子数为NA |
20.下列说法不正确的是( )
| A. | 检验Cl-的试剂是硝酸银和硝酸 | |
| B. | 检验SO${\;}_{4}^{2-}$的试剂是氯化钡和盐酸 | |
| C. | 检验CO${\;}_{3}^{2-}$的试剂是盐酸、澄清石灰水和氯化钙 | |
| D. | 向溶液中加入BaCl2溶液后生成白色沉淀,即可证明有SO${\;}_{4}^{2-}$ |
7.m A(g)+n B(g)?p c(g),在同一压强下变化如图,叙述正确的是( )
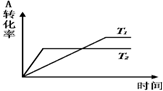

| A. | T1>T2,正反应是吸热反应 | B. | T1<T2,正反应是放热反应 | ||
| C. | T1<T2,正反应是吸热反应 | D. | T1>T2,正反应是放热反应 |
1.在下列溶液中,常温下各组离子一定能够大量共存的是( )
| A. | c(H+)=10-12 mol/L的溶液:K+、Ba2+、Cl-、Br- | |
| B. | 使紫色石蕊试液变红的溶液:Fe2+、Mg2+、NO3-、Cl- | |
| C. | 碳酸氢钠溶液:K+、SO42-、Cl-、H+ | |
| D. | 使酚酞试液变红的溶液:Na+、Cl-、SO42-、Fe3+ |
2.下列有关说法错误的是( )
| A. | 普通玻璃和钢化玻璃的成分不一样,钢化玻璃中加了玻璃钢 | |
| B. | 水泥的主要成分是硅酸二钙、硅酸三钙和铝酸三钙 | |
| C. | 水泥具有水硬性,因此在保存和运输过程中要注意防水防潮 | |
| D. | 陶瓷的釉料在烧制时,若空气过量,一般显示的是高价态的金属的颜色 |