题目内容
10.如图表示在密闭容器中反应:2SO2(g)+O2(g)?2SO3(g)△H<0 达到平衡时,由于条件改变而引起反应速率和化学平衡的变化情况,试回答下列问题: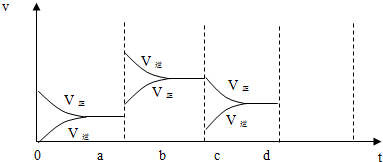
(1)a b过程中改变的条件可能是升温;
(2)b c过程中改变的条件可能是减小SO3浓度;
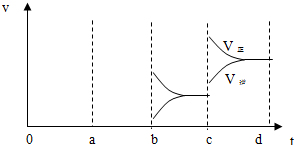
(3)若增大压强时,反应速率变化情况画在c~d处.,并标出正逆反应
 .
.
分析 (1)由图可知,ab过程正逆反应速率均增大,且逆反应速率大于正反应速率;
(2)由图可知,bc过程瞬间正反应速率不变,逆反应速率减小,应为减小生成物的浓度;
(3)增大压强,平衡正向移动,则正逆反应速率均增大,且正反应速率大于逆反应速率.
解答 解:(1)由图可知,ab过程正逆反应速率均增大,且逆反应速率大于正反应速率,若加压正反应速率大于逆反应速率,该反应为放热反应,则升温符合,
故答案为:升温;
(2)由图可知,bc过程瞬间正反应速率不变,逆反应速率减小,应为减小生成物的浓度,即改变条件为减小SO3 浓度,故答案为:减小SO3 浓度;
(3)增大压强,平衡正向移动,则正逆反应速率均增大,且正反应速率大于逆反应速率,如图为 ,
,
故答案为: .
.
点评 本题考查反应速率与图象,为高频考点,把握温度、压强、浓度对反应速率的影响为解答的关键,侧重分析与应用能力的考查,注意化学反应的特点,题目难度不大.

练习册系列答案
相关题目
20.下列关于物质的量浓度表述正确的是( )
| A. | 0.2mol•L-1Na2SO4溶液中含有Na+和SO42-总物质的量为0.6mol | |
| B. | 50mL2mol•L-1NaCl溶液和100mL0.5mol•L-1MgCl2溶液中,Cl-的物质的量浓度相等 | |
| C. | 用1L水吸收22.4L氯化氢所得盐酸的浓度是1mol•L-1 | |
| D. | 10g98%的硫酸(密度为1.84g•cm-3)与10mL18.4mol•L-1的硫酸的浓度是相同的 |
1.能证明次氯酸是弱酸的事实是( )
| A. | 能与NaOH溶液反应 | |
| B. | 能使品红溶液褪色 | |
| C. | 见光能分解 | |
| D. | 向Ca(ClO)2 溶液中通入CO2能生成次氯酸 |
18.将a mol/L Al2(SO4)3和钾离子浓度为2b mol/L的 K2SO4混合溶液500mL加水稀释到2L,则稀释后的溶液中SO42-的浓度为( )mol/L.
| A. | $\frac{a+b}{4}$ | B. | $\frac{3a+2b}{4}$ | C. | 4(a+b) | D. | 4(3a+b) |
5.在一定温度下,向a L密闭容器中加入1mol X气体和2mol Y气体,发生如下反应:X(g)+2Y(g)?3Z(g)此反应达到平衡的标志是( )
| A. | 容器内压强不随时间变化而变化 | |
| B. | 单位时间消耗0.1mol X同时生成0.3mol Z | |
| C. | 容器内X、Y、Z的浓度之比为1:2:3 | |
| D. | 容器内各物质的浓度不随时间变化而变化 |
15.关于胶体和溶液的区别,下列叙述中正确的是( )
| A. | 胶体通直流电胶粒向两极移动,非电解质溶液通直流电溶质不移动 | |
| B. | 溶液中溶质粒子能通过滤纸,胶体中分散质粒子不能通过滤纸 | |
| C. | 溶液中通过一束光线没有特殊现象,胶体中通过一束光线出现明显光带 | |
| D. | 溶液稳定,放置后不会生成沉淀;胶体不稳定,放置会生成沉淀 |
2.氧化还原反应中,水的作用可以是氧化剂、还原剂、既是氧化剂又是还原剂、既非氧化剂又非还原剂等.下列反应与Br2+SO2+2H2O=H2SO2+2HBr相比较,水的作用相同的是( )
| A. | 电解水:2H20═2H2↑+O2↑ | B. | 2Na+2H2O═2NaOH+H2↑ | ||
| C. | 2F2+H2O═4HF+O2 | D. | 3NO2+H2O═2HNO3+NO |
19.恒温恒压的密闭容器中发生反应A(g)+2B(g)?3C(g),能说明反应达到平衡状态的是( )
| A. | 容器内的压强不再变化 | |
| B. | 混合气体的密度不再变化 | |
| C. | 单位时间消耗2molA,同时消耗6molC | |
| D. | 混合气体的平均相对分子质量不再变化 |
20.下列有关金属腐蚀的叙述正确的是( )
| A. | 金属越纯越不易被腐蚀 | |
| B. | 干燥环境下金属不被腐蚀 | |
| C. | 铜一定比铁难腐蚀 | |
| D. | 金属的腐蚀有化学腐蚀和电化学腐蚀 |