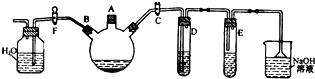
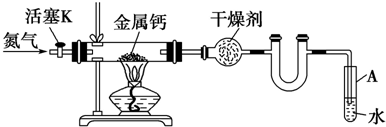
11.回答下列有关重要化工原料甲醇的有关问题
(1)合成气用于制备甲醇的反应为2H2(g)+CO(g)?CH3OH(g)△H
①根据下表中有关化学键键能数据求算该反应的△H=-99kJ.mol-1
②在T℃、恒容条件下,该反应的平衡常数Kp=6.0×10-3(kPa)-2.若起始时投入2molH2、1molCO,反应达到平衡时p(CH3OH)=24.0kPa,则平衡混合气体中CH3OH的物质的量分数约为44.4%(Kp是平衡分压代替平衡浓度计算所得平衡常数,分压=总压×物质的量分数).根据化学反应原理,分析增加压强对制备甲醇反应的影响增大压强使反应体系各组分浓度增大,反应速率加快,正反应为气体物质的量减小的反应,压强增大平衡正向移动,H2、CO的转化率增大,CH3OH的产率增大
(2)利用甲醇合成二甲醚的反应如下:2CH3OH(g)?CH3OCH3(g)+H2O(g),一定温度下,在三个体积均为1.0L的恒容密闭容器中发生该反应:
①$\frac{x}{y}$=$\frac{1}{2}$
②已知387℃时该反应的化学平衡常数K=4.若起始时项容器Ⅰ中充入0.1molCH3OH、0.15molCH3OCH3和0.10molH2O,则反应将向正(填“正”或“逆”)反应方向进行
③容器Ⅱ中反应达到平衡后,若要进一步提高甲醚的产率,可以采取的温度方面的措施是降低温度
(3)用甲醇电化学合成(CH3O)2CO的工作 原理如图所示
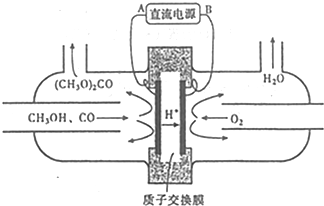
电源负极为B(填“A”或“B”),写出阳极的电极反应式2CH3OH+CO-2e-=(CH3O)2CO+2H+.若参加反应的O2为1.12m3(标准状况),则制得(CH3O)2CO的质量为9kg.
(1)合成气用于制备甲醇的反应为2H2(g)+CO(g)?CH3OH(g)△H
①根据下表中有关化学键键能数据求算该反应的△H=-99kJ.mol-1
| 化学键 | H-H | C-O | C≡O | H-O | C-H |
| E/(kJ•mol-1) | 436 | 343 | 1076 | 465 | 413 |
(2)利用甲醇合成二甲醚的反应如下:2CH3OH(g)?CH3OCH3(g)+H2O(g),一定温度下,在三个体积均为1.0L的恒容密闭容器中发生该反应:
| 容器编号 | 温度(℃) | 起始物质的量(mol) | 平衡物质的量(mol) | |
| CH3OH(g) | CH3OCH3(g) | H2O | ||
| Ⅰ | 387 | 0.20 | x | |
| Ⅱ | 387 | 0.40 | y | |
| Ⅲ | 207 | 0.20 | 0.090 | 0.090 |
②已知387℃时该反应的化学平衡常数K=4.若起始时项容器Ⅰ中充入0.1molCH3OH、0.15molCH3OCH3和0.10molH2O,则反应将向正(填“正”或“逆”)反应方向进行
③容器Ⅱ中反应达到平衡后,若要进一步提高甲醚的产率,可以采取的温度方面的措施是降低温度
(3)用甲醇电化学合成(CH3O)2CO的工作 原理如图所示

电源负极为B(填“A”或“B”),写出阳极的电极反应式2CH3OH+CO-2e-=(CH3O)2CO+2H+.若参加反应的O2为1.12m3(标准状况),则制得(CH3O)2CO的质量为9kg.
9. 目前工业上有一种方法是用CO2生产燃料甲醇.一定条件下发生反应:CO2+3H2?CH3OH+H2O,该反应的能量变化如图所示:
目前工业上有一种方法是用CO2生产燃料甲醇.一定条件下发生反应:CO2+3H2?CH3OH+H2O,该反应的能量变化如图所示:
(1)甲同学认为该反应为放热反应,他的理由为:反应物的总能大于生成物的总能量
(2)在体积为2L的密闭容器中,充入1mol CO2和3mol H2,测得CO2的物质的量随时间变化如表所示.从反应开始到5min末,用CO2浓度变化表示的平均反应速率v(CO2)=0.05mol/(L.min);
反应达到平衡状态,此时H2的转化率为75%.
(3)在相同温度、容积不变的条件下,能说明该反应已达平衡状态的是bd(填序号).
a.v生成(CH3OH)=v消耗(CO2)
b.CO2、H2、CH3OH、H2O的浓度均不再变化
c.n(CO2):n(H2):n(CH3OH):n(H2O)=1:1:1:1
d.H2的消耗速率与CH3OH的消耗速率之比为3:1.
 目前工业上有一种方法是用CO2生产燃料甲醇.一定条件下发生反应:CO2+3H2?CH3OH+H2O,该反应的能量变化如图所示:
目前工业上有一种方法是用CO2生产燃料甲醇.一定条件下发生反应:CO2+3H2?CH3OH+H2O,该反应的能量变化如图所示:(1)甲同学认为该反应为放热反应,他的理由为:反应物的总能大于生成物的总能量
(2)在体积为2L的密闭容器中,充入1mol CO2和3mol H2,测得CO2的物质的量随时间变化如表所示.从反应开始到5min末,用CO2浓度变化表示的平均反应速率v(CO2)=0.05mol/(L.min);
反应达到平衡状态,此时H2的转化率为75%.
| t/min | 0 | 2 | 5 | 10 | 15 |
| n(CO2)/mol | 1 | 0.75 | 0.5 | 0.25 | 0.25 |
a.v生成(CH3OH)=v消耗(CO2)
b.CO2、H2、CH3OH、H2O的浓度均不再变化
c.n(CO2):n(H2):n(CH3OH):n(H2O)=1:1:1:1
d.H2的消耗速率与CH3OH的消耗速率之比为3:1.
8. 汽车作为一种现代交通工具正在进入千家万户,汽车尾气中含有CO、NOx等有毒气体,其污染问题也成为当今社会急需解决的问题.
汽车作为一种现代交通工具正在进入千家万户,汽车尾气中含有CO、NOx等有毒气体,其污染问题也成为当今社会急需解决的问题.
(1)汽车发动机工作时会引发N2和O2反应,其能量变化示意图如图:则该反应的热化学方程式为N2(g)+O2(g)=2NO(g)△H=+183 kJ/moL.
(2)一氧化碳是一种用途相当广泛的化工基础原料.可以还原金属氧化物,还可以用来合成很多有机物如甲醇等.在压强为0.1MPa条件下,将amolCO与3amolH2的混合气体在催化剂作用下反应生成甲醇:
CO(g)+2H2(g)?CH3OH(g)△H=-bkJ•mol-1
①该反应的平衡常数表达式为$\frac{c(C{H}_{3}OH)}{c(CO)×{c}^{2}({H}_{2})}$.
②若容器容积不变,下列措施可增加甲醇产率的是BD.
A.升高温度 B.将CH3OH(g)从体系中分离 C.充入He,使体系总压强增大D.再充入1molCO和3molH2
③经测定不同温度下该反应的平衡常数如下:
若某时刻、250℃测得该反应的反应物与生成物的浓度为c(CO)=0.4mol•L-1、c(H2)=0.4mol•L-1、c(CH3OH)=0.8mol•L-1,则此时v正<v逆(填“>”、“<”或“=”).
(3)甲醇是重要的基础化工原料,又是一种新型的燃料,最近有人制造了一种燃料电池,一个电极通入空气,另一个电极加入甲醇,电池的电解质是掺杂了Y2O3的ZrO2晶体,它在高温下能传导O2-离子.该电池的负极反应式为CH3OH+3O2--6e-═CO2+2H2O.电池工作时,固体电解质里的O2-向负极移动.
 汽车作为一种现代交通工具正在进入千家万户,汽车尾气中含有CO、NOx等有毒气体,其污染问题也成为当今社会急需解决的问题.
汽车作为一种现代交通工具正在进入千家万户,汽车尾气中含有CO、NOx等有毒气体,其污染问题也成为当今社会急需解决的问题.(1)汽车发动机工作时会引发N2和O2反应,其能量变化示意图如图:则该反应的热化学方程式为N2(g)+O2(g)=2NO(g)△H=+183 kJ/moL.
(2)一氧化碳是一种用途相当广泛的化工基础原料.可以还原金属氧化物,还可以用来合成很多有机物如甲醇等.在压强为0.1MPa条件下,将amolCO与3amolH2的混合气体在催化剂作用下反应生成甲醇:
CO(g)+2H2(g)?CH3OH(g)△H=-bkJ•mol-1
①该反应的平衡常数表达式为$\frac{c(C{H}_{3}OH)}{c(CO)×{c}^{2}({H}_{2})}$.
②若容器容积不变,下列措施可增加甲醇产率的是BD.
A.升高温度 B.将CH3OH(g)从体系中分离 C.充入He,使体系总压强增大D.再充入1molCO和3molH2
③经测定不同温度下该反应的平衡常数如下:
| 温度(℃) | 250 | 300 | 350 |
| K | 2.041 | 0.270 | 0.012 |
(3)甲醇是重要的基础化工原料,又是一种新型的燃料,最近有人制造了一种燃料电池,一个电极通入空气,另一个电极加入甲醇,电池的电解质是掺杂了Y2O3的ZrO2晶体,它在高温下能传导O2-离子.该电池的负极反应式为CH3OH+3O2--6e-═CO2+2H2O.电池工作时,固体电解质里的O2-向负极移动.
7.在一定温度下,10 mL 0.40 mol/L H2O2溶液发生催化分解,不同时刻测得生成O2的体积(已折算为标准状况)如表.忽略溶液体积变化,下列叙述不正确的是( )
0 172369 172377 172383 172387 172393 172395 172399 172405 172407 172413 172419 172423 172425 172429 172435 172437 172443 172447 172449 172453 172455 172459 172461 172463 172464 172465 172467 172468 172469 172471 172473 172477 172479 172483 172485 172489 172495 172497 172503 172507 172509 172513 172519 172525 172527 172533 172537 172539 172545 172549 172555 172563 203614
| t/min | 0 | 2 | 4 | 6 | 8 | 10 |
| V(O2)/mL | 0.0 | 9.6 | 16.8 | 22.4 | 26.5 | 29.9 |
| A. | 2 min时H2O2的浓度c(H2O2)=0.314 mol/L | |
| B. | 0~4 min的平均反应速率v(H2O2)=3.75×10-2 mol/(L•min) | |
| C. | 0~10 min内,过氧化氢的分解速率逐渐加快 | |
| D. | 反应到6 min时,H2O2分解了50% |