题目内容
5.高锰酸钾在实验室和医疗上有非常广泛的应用.以下是工业上用软锰矿(主要含MnO2)制备高锰酸钾晶体的一种工艺流程:
(1)上述生产过程中,第①步的氧化剂为(写化学式)O2.
(2)第②步反应的化学方程式是3K2MnO4+2CO2═2KMnO4+2K2CO3+MnO2.
(3)由母液制得KOH应加入的物质是Ba(OH)2或Ca(OH)2或CaO等.写出相应化学方程式Ca(OH)2+K2CO3═CaCO3↓+2KOH.
(4)操作Ⅰ用到的仪器有漏斗、烧杯、玻璃棒、铁架台(带铁圈),操作Ⅱ是根据KMnO4和K2CO3两种物质在溶解度上的差异,采用蒸发结晶、趁热过滤得到KMnO4粗晶体.
分析 本题是工业上用软锰矿(主要含MnO2)制备高锰酸钾晶体的一种工艺流程,其中软锰矿先与KOH的熔融物在有氧气做氧化剂前提下等到K2MnO4,再向K2MnO4溶液里通CO2制KMnO4,同时等到不溶的MnO2,通过过滤除去不溶物,再滤液进行分离提纯得到KMnO4粗晶体;
(1)软锰矿先与KOH的熔融物在有氧气参与反应的前提下等到K2MnO4,其中Mn元素的化合价升高,MnO2是还原剂,氧气是还原剂;
(2)第②步是向K2MnO4溶液里通CO2制KMnO4,同时得到K2CO3,可见反应中Mn元素的化合价既升高又降低,还原产物应为MnO2;
(3)将K2CO3转化为KOH,应选择一种碱溶液,同时根据复分解反应的条件,要生成不溶性的碳酸盐;
(4)操作Ⅰ是过滤,可结合过滤操作选择仪器,KMnO4和KOH的混合溶液中得到,可结合两者的溶解度随温度变化情况,选择重结果进行分离得到KMnO4粗晶体.
解答 解:(1)软锰矿与KOH的熔融物在有氧气作氧化剂的前提下等到K2MnO4,故答案为:O2;
(2)向K2MnO4溶液里通CO2制KMnO4和K2CO3,根据化合价升降可知还原产物为MnO2,发生反应的化学方程式为3K2MnO4+2CO2═2KMnO4+2K2CO3+MnO2,故答案为:3K2MnO4+2CO2═2KMnO4+2K2CO3+MnO2;
(3)根据复分解反应的条件,只要选择Ca(OH)2或Ba(OH)2就可以将K2CO3转化为KOH,发生反应的化学方程式为Ca(OH)2+K2CO3═Ca CO3↓+2KOH,
故答案为:Ba(OH)2或Ca(OH)2或CaO等;Ca(OH)2+K2CO3═Ca CO3↓+2KOH;
(4)过滤操作用到的仪器有漏斗、烧杯、玻璃棒、铁架台(带铁圈),可利用溶解度的差异通过蒸发浓缩,冷却结晶的方法分离KMnO4和KOH的混合溶得到KMnO4粗晶体,故答案为:漏斗、烧杯、玻璃棒、铁架台(带铁圈);溶解度.
点评 本题是属制备实验操作的设计与评价,涉及氧化还原反应的分析及混合物的分离提纯,难度中等,重点考查学生的基础掌握情况.

 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案| A. | 在光照条件下,甲烷与氯水发生取代反应 | |
| B. | 有机反应中,卤代、硝化、磺化、酯化、水解反应等不完全是取代反应 | |
| C. | 乙醇可与水以任意比例混溶,是因为与水形成了氢键 | |
| D. | 若烃中碳、氢元素的质量分数相同.它们必定是同系物 |
| A. | 碳酸钡和稀硫酸:BaCO3+2H+═Ba2++CO2↑+H2O | |
| B. | CO2通入足量的NaOH溶液中:CO2+OH-═HCO3- | |
| C. | 向FeCl2溶液中通入Cl2反应生成FeCl3溶液:Fe2++Cl2═Fe3++2Cl- | |
| D. | 少量CO2通入澄清石灰水中:CO2+Ca2++2OH-═CaCO3↓+H2O |
| A. | 标准状况下,22.4L H2O含有的分子数等于0.1NA | |
| B. | 分子数为NA的CO、C2H4混合气体体积约为22.4L,质量为28g | |
| C. | 常温常压下,1 mol 甲烷分子中所含质子数为10NA | |
| D. | 标准状况下,22.4L乙醇的分子数为NA |
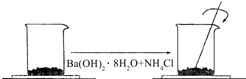 在一个小烧杯里,加入 40g Ba(OH)2•8H2O粉末,将小烧杯放在事先已滴有4~5滴水的玻璃片上.然后加入20g NH4Cl晶体,并用玻璃棒迅速搅拌.如图所示.回答下列问题:
在一个小烧杯里,加入 40g Ba(OH)2•8H2O粉末,将小烧杯放在事先已滴有4~5滴水的玻璃片上.然后加入20g NH4Cl晶体,并用玻璃棒迅速搅拌.如图所示.回答下列问题: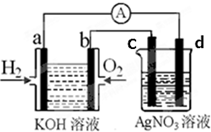 化学在能源开发与利用中起到十分关键的作用.氢气是一种新型的绿色能源,又是一种重要的化工原料.氢氧燃料电池能量转化率高,具有广阔的发展前景.现用氢氧燃料电池进行如图实验(图中所用电极均为惰性电极)
化学在能源开发与利用中起到十分关键的作用.氢气是一种新型的绿色能源,又是一种重要的化工原料.氢氧燃料电池能量转化率高,具有广阔的发展前景.现用氢氧燃料电池进行如图实验(图中所用电极均为惰性电极)