题目内容
3.无水氯化铝是白色晶体,易吸收水分,在178℃升华,装有无水氯化铝露置于潮湿空气中会爆炸并产生大量白雾,工业上由金属与氯气作用而制得,某课外活动小组在实验室内通过下列装置(如图)制取少量纯净的无水氯化铝.
试回答以下问题:
(1)仪器名称a:分液漏斗,b:干燥管
(2)装置A中反应的化学方程式MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2 ↑+2H2O.
(3)装置B、C中所盛装的试剂分别是:饱和食盐水、浓硫酸
(4)装置F的作用有两个,一是吸收多余的氯气,防止污染环境,二是防止空气中的水蒸气进入D中
(5)实验开始时,应先点燃A(填A或D)处的酒精灯.
(6)某同学从百度百科上查得氯化铝为共价化合物.简述用实验证明氯化铝为共价化合物的方法:
设计实验证明氯化铝在熔融状态下不导电.
分析 根据实验装置,A中用浓盐酸与二氧化锰反应生成氯气,制得的氯气中常有氯化氢和水蒸气杂质,所以用B装置中的饱和食盐水除氯化氢,用C装置中的浓硫酸干燥,制得的氯气在D装置中与铝反应生成氯化铝,氯化铝易水解,要防止空气中的水蒸气进入,同时氯气有毒,不能排放到空气中,所以用E装置装碱石灰进行吸收和干燥,(1)根据装置图可写出仪器名称;
(2)根据浓盐酸和二氧化锰的性质判断生成物,从而确定方程式;
(3)氯化氢易挥发,制取的氯气中含有氯化氢和水,进入装置D前应除去,依据氯化氢、浓硫酸的性质选择合适的试剂;
(4)氯气有毒,尾气要吸收,不能直接排放到空气中,同时空气中的水蒸气不能进入装置D中;
(5)为了制取纯净的无水氯化铝,需排净装置中的空气,点燃A酒精灯用产生的氯气来排净空气后再点燃B酒精灯开始反应制取无水氯化铝;
(6)共价化合物在熔融状态下不电离,离子化合物在熔融状态下能电离;
解答 解:根据实验装置,A中用浓盐酸与二氧化锰反应生成氯气,制得的氯气中常有氯化氢和水蒸气杂质,所以用B装置中的饱和食盐水除氯化氢,用C装置中的浓硫酸干燥,制得的氯气在D装置中与铝反应生成氯化铝,氯化铝易水解,要防止空气中的水蒸气进入,同时氯气有毒,不能排放到空气中,所以用E装置装碱石灰进行吸收和干燥,
(1)根据装置图可知,仪器名称a为分液漏斗,仪器名称b为干燥管,
故答案为:分液漏斗;干燥管;
(2)浓盐酸和二氧化锰在加热条件下能发生氧化还原反应生成氯化锰、氯气、水,反应方程式为MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2 ↑+2H2O,
故答案为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2 ↑+2H2O;
(3)浓盐酸具有挥发性,所以混合气体中含有氯化氢;氯化氢极易溶于水,氯气在饱和食盐水中溶解度不大,可以选择饱和食盐水吸收氯化氢,浓硫酸具有吸水性,能够干燥氯气,
故答案为:饱和食盐水,浓硫酸;
(4)氯气有毒,污染环境,所以不能排空;碱石灰的成分是氧化钙和氢氧化钠,氯气和氧化钙、氢氧化钠能反应达到,所以可用碱石灰处理尾气;空气中有水蒸气,碱石灰还能吸收水蒸气,所以可作干燥剂.
故答案为:吸收多余的氯气,防止污染环境;防止空气中的水蒸气进入D中;
(5)为了制取纯净的无水氯化铝,需排净装置中的空气,点燃A酒精灯用产生的氯气来排净空气后再点燃B酒精灯开始反应制取无水氯化铝,
故答案为:A;
(6)共价化合物在熔融状态下不电离,离子化合物在熔融状态下能电离,所以证明氯化铝为共价化合物的方法是设计实验证明氯化铝在熔融状态下不导电,
故答案为:设计实验证明氯化铝在熔融状态下不导电.
点评 本题通过氯化铝的制取,考查了氯气的制备和性质的检验,熟悉反应原理是解题关键,题目难度中等.

| A. | CH3CH2 CH2OH | B. | CH3COOH | C. | H2O | D. | H2CO3 |
| A. | Cl-和Cl2均有毒 | B. | Cl-和Cl2均呈黄绿色 | ||
| C. | 相比较,Cl-稳定,Cl2活泼 | D. | Cl-和Cl2均能与金属单质反应 |
| A. | 反应①中的K0H、Cl2和H2都是电解质 | |
| B. | 反应②属于离子反应 | |
| C. | 若反应①消耗7.45gKCl,可以制备标准状况下4.48L氯气 | |
| D. | 反应②中氧化剂和还原剂的质量之比是1:5 |
 汽车作为一种现代交通工具正在进入千家万户,汽车尾气中含有CO、NOx等有毒气体,其污染问题也成为当今社会急需解决的问题.
汽车作为一种现代交通工具正在进入千家万户,汽车尾气中含有CO、NOx等有毒气体,其污染问题也成为当今社会急需解决的问题.(1)汽车发动机工作时会引发N2和O2反应,其能量变化示意图如图:则该反应的热化学方程式为N2(g)+O2(g)=2NO(g)△H=+183 kJ/moL.
(2)一氧化碳是一种用途相当广泛的化工基础原料.可以还原金属氧化物,还可以用来合成很多有机物如甲醇等.在压强为0.1MPa条件下,将amolCO与3amolH2的混合气体在催化剂作用下反应生成甲醇:
CO(g)+2H2(g)?CH3OH(g)△H=-bkJ•mol-1
①该反应的平衡常数表达式为$\frac{c(C{H}_{3}OH)}{c(CO)×{c}^{2}({H}_{2})}$.
②若容器容积不变,下列措施可增加甲醇产率的是BD.
A.升高温度 B.将CH3OH(g)从体系中分离 C.充入He,使体系总压强增大D.再充入1molCO和3molH2
③经测定不同温度下该反应的平衡常数如下:
| 温度(℃) | 250 | 300 | 350 |
| K | 2.041 | 0.270 | 0.012 |
(3)甲醇是重要的基础化工原料,又是一种新型的燃料,最近有人制造了一种燃料电池,一个电极通入空气,另一个电极加入甲醇,电池的电解质是掺杂了Y2O3的ZrO2晶体,它在高温下能传导O2-离子.该电池的负极反应式为CH3OH+3O2--6e-═CO2+2H2O.电池工作时,固体电解质里的O2-向负极移动.
| t/℃ | 700 | 800 | 830 | 1 000 | 1 200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
| A. | 此反应为放热反应 | |
| B. | 此反应只有达到平衡时,密闭容器中的压强才不会变化 | |
| C. | 此反应达到1 000℃时的反应速率比700℃时大 | |
| D. | 该反应的化学平衡常数越大,反应物的转化率越低 |

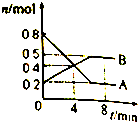 某温度时.在2L密闭容器中某一反应的A、B物质的量随时间变化的曲线如图所示,
某温度时.在2L密闭容器中某一反应的A、B物质的量随时间变化的曲线如图所示,