题目内容
2.某实验小组利用如下装置(部分固定装置略)制备氮化钙(Ca3N2),并探究其实验式.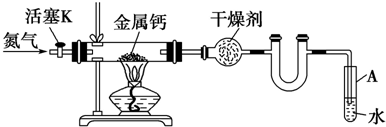
(1)若装置不用U型管,实验也能顺利进行,原因是:实验过程持续通入N2,不会引起A中水倒吸
(2)反应过程中末端导管必须终插入试管A的水中,目的是①便于观察N2的流速,
②防止反应过程中空气进入反应管
(3)制备氮化钙的操作步骤是:
①打开活塞K并通入N2;
②点燃酒精灯,进行反应;
③反应结束后,熄灭酒精灯,待反应管冷却至室温,停止通入N2,并关闭活塞K;
④拆除装置,取出产物.
(4)数据记录如下:
①空瓷舟质量m0/g;
②瓷舟与钙的质量m1/g;
③瓷舟与产物的质量m2/g
①计算得到实验式CaxN2,其中x=$\frac{7(m1-m0)}{10(m2-m1)}$(用m0、m1、m2表示)
②若通入的N2中混有少量O2,理论值比实际测得x值偏大(填“偏大”或“偏小”)
分析 (1)装置中的U型管主要是防止倒吸,而实验中是持续能入氮气的,据此答题;
(2)要保证整个装置不能混入其他气体;
(3)一定要使玻璃管冷却后再停止通入气流;
(4)①要确定x值必须求出钙和氮的原子个数比根据题目给的数据可做如下计算,m(Ca)=(m1-m0)g,m(N)=(m2-m1)g,则n(Ca):n(N)=$\frac{{m}_{1-}m{\;}_{0}}{40}$:$\frac{m{\;}_{2}-{m}_{1}}{14}$,据此求得x;
②若通入的N2中混有少量O2,则产物中就有可能混有了CaO,从而导致氮的质量偏小,据此分析;
解答 解:(1)装置中的U型管主要是防止倒吸,而实验中是持续能入氮气的,所以不用U型管,也不会引起A中水倒吸,
故答案为:实验过程持续通入N2,不会引起A中水倒吸;
(2)防止反应过程中空气进入反应管,
故答案为:防止反应过程中空气进入反应管;
(3)实验结束时,熄灭酒精灯,待反应管冷却至室温,停止通入N2,并关闭活塞K,
故答案为:待反应管冷却至室温,停止通入N2,并关闭活塞K;
(4)①要确定x值必须求出钙和氮的原子个数比根据题目给的数据可做如下计算,m(Ca)=(m1-m0)g,m(N)=(m2-m1)g,则n(Ca):n(N)=$\frac{{m}_{1-}m{\;}_{0}}{40}$:$\frac{m{\;}_{2}-{m}_{1}}{14}$,所以x:2=$\frac{{m}_{1-}m{\;}_{0}}{40}$:$\frac{m{\;}_{2}-{m}_{1}}{14}$,x=$\frac{7(m1-m0)}{10(m2-m1)}$,
故答案为:$\frac{7(m1-m0)}{10(m2-m1)}$;
②若通入的N2中混有少量O2,则产物中就有可能混有了CaO,从而导致氮的质量偏小,所以x值偏大,
故答案为:偏大.
点评 本题主要考查学生化学实验基本操作技能和处理问题的能力,以及对实验结果进行计算和误差分析判断的能力.

 名校课堂系列答案
名校课堂系列答案| A. | 它们均属于糖类,且互为同系物 | |
| B. | 二者含有C、H、O三种元素的质量分数相同,且互为同分异构体 | |
| C. | 二者都能水解,且水解的最终产物相同 | |
| D. | 都可用(C6H10O5)n表示,但淀粉能发生银镜反应,而纤维素不能 |
| A. | S2-→HS- | B. | FeCl2→FeCl3 | C. | H2SO4→SO2 | D. | HNO3→N2O |
| A. | W03中W的化合价是+3价 | |
| B. | W03属于非金属氧化物 | |
| C. | 当消耗22.4L氢气时可以得到$\frac{1}{3}$ mol W | |
| D. | 当有1.8g水生成时,转移0.2 mol电子 |
| t/min | 0 | 2 | 4 | 6 | 8 | 10 |
| V(O2)/mL | 0.0 | 9.6 | 16.8 | 22.4 | 26.5 | 29.9 |
| A. | 2 min时H2O2的浓度c(H2O2)=0.314 mol/L | |
| B. | 0~4 min的平均反应速率v(H2O2)=3.75×10-2 mol/(L•min) | |
| C. | 0~10 min内,过氧化氢的分解速率逐渐加快 | |
| D. | 反应到6 min时,H2O2分解了50% |
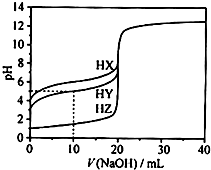 25℃时,用浓度为0.1000mol•L-1的NaOH溶液滴定20.00mL浓度均为0.1000mol•L-1的三种酸HX、HY、HZ滴定曲线如图所示.下列说法正确的是( )
25℃时,用浓度为0.1000mol•L-1的NaOH溶液滴定20.00mL浓度均为0.1000mol•L-1的三种酸HX、HY、HZ滴定曲线如图所示.下列说法正确的是( )| A. | 根据滴定曲线,可得Ka(HY)≈10-9 | |
| B. | 在相同温度下,同浓度的三种酸溶液的导电能力顺序:HZ<HY<HX | |
| C. | HY与HZ混合,达到平衡时:c(H+)=$\frac{Ka(HY)•c(HY)}{c({Y}^{-})}$+c(Z-)+c(OH-) | |
| D. | 将上述HX、HY溶液等体积混合后,用NaOH溶液滴定至HX恰好完全反应时:c(Na+)>c(Y-)>c(X-)>c(OH-)>c(H+) |

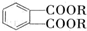 (代号DMP)是一种常用的酯类塑化剂,其蒸气对氢气的相对密度为97.工业上生产DMP的流程如图所示:
(代号DMP)是一种常用的酯类塑化剂,其蒸气对氢气的相对密度为97.工业上生产DMP的流程如图所示:
 的名称1,2-二甲苯(或邻二甲苯),C中官能团的名称为醛基,DMP的分子式为C10H10O4.
的名称1,2-二甲苯(或邻二甲苯),C中官能团的名称为醛基,DMP的分子式为C10H10O4.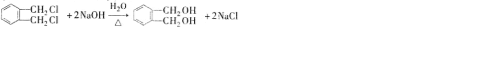 .
.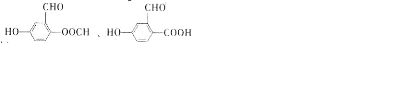 .
. 制备DMP的另一种途径:
制备DMP的另一种途径: