19.化学在生产和日常生活中有着重要的应用.下列说法错误的是( )
| A. | 过氧化钠可用于食品、羽毛和织物等的漂白 | |
| B. | 含盐腌制品不宜直接存放在铝制容器中 | |
| C. | 燃放烟花是利用了某些金属元素的焰色反应 | |
| D. | 铝比铁活泼,但铝制品比铁制品在空气中耐腐蚀 |
18.若NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A. | 0.1mol氯气与金属铁完全反应时,转移电子数为0.2NA | |
| B. | 100mL 1mol/L NaHCO3溶液含有0.1NA个HCO3- | |
| C. | 7.1g氯气与足量NaOH溶液反应电子转移数为0.2NA | |
| D. | 0.1molNa2O2中含有的离子数为0.4NA |
17.用下列实验装置进行相应实验,装置正确且能达到实验目的是( )
| A. | 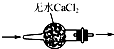 干燥SO2气体 | |
| B. |  蒸发CH3COONa溶液得醋酸钠晶体 | |
| C. |  分离有机层与水层,水层从分液漏斗下口放出 | |
| D. | 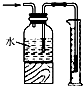 测量氯气的体积 |
16.下列有关说法正确的是( )
| A. | 硅相对于氢气便于运输、贮存,从安全角度考虑,硅是有开发价值的燃料 | |
| B. | 硅在地壳中含量居第二位,在地球上有丰富的硅资源,如石英、水晶、玛瑙的主要成分都是单质硅 | |
| C. | 存放NaOH溶液的试剂瓶应用玻璃塞 | |
| D. | 二氧化硅是一种良好的半导体材料 |
14.氨的合成是最重要的化工生产之一.
Ⅰ.工业上合氨用的H2有多种制取的方法:
①用焦炭跟水反应:C(s)+H2O(g)$\frac{\underline{\;高温\;}}{\;}$CO(g)+H2(g);
②用天然气中水蒸气反应:CH4(g)+H2O(g)$\frac{\underline{\;催化剂\;}}{高温}$CO(g)+3H2(g)
已知有关反应的能量变化如图所示,且方法②的反应只能在高温下发生,则方法②中反应的△H=(a+3b-c)KJ/mol.

Ⅱ.在3个1L的密闭容器中,同温度下、使用相同催化剂分别进行反应:
3H2(g)+N2(g)$?_{催化剂}^{高温、高压}$2NH3(g),按不同方式设入反应物,保持恒温、恒容,反应达到平衡时有关数据为:
(1)下列能说明该反应已达到平衡状态的是c.
a.容器内N2、H2、NH3的浓度之比为1:3:2 b.v(N2)正=3v(H2)逆
c.容器内压强保持不变 d.混合气体的密度保持不变
(2)甲容器中达到平衡所需的时间t>5min(填“>”、“<”或“=”).
(3)乙中从反应开始到平衡时N2的平均反应速率0.2mol/(L.min),(注明单位).
(4)分析上表数据,下列关系正确的是c.
a.2c1=3mol/L b.ω1=ω2 c.2ρ1=ρ2
(5)该温度下,容器乙中,该反应的平衡常数K=$\frac{4}{81}$(用分数表示)(mol/L)-2.
Ⅲ.(1)有人设想以N2和H2为反应物,以溶有A的稀盐酸为电解质溶液,可制造出既能提供电能,又能固氮的新型燃料电池,装置如图1所示.
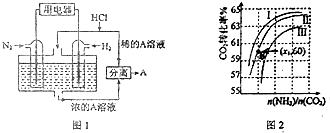
电池正极的电极反应式是N2+8H++6e-=2NH4+,A是氯化铵.
(2)用氨合成尿素的反应为2NH3(g)+CO2(g)?CO(NH2)2(s)+H2O(g).工业生产时,原料气带有水蒸气.图2表示CO2的转化率与氨碳比$\frac{n(N{H}_{3})}{n(C{O}_{2})}$、水碳比$\frac{n({H}_{2}O)}{n(C{O}_{2})}$的变化关系.
①曲线Ⅰ、Ⅱ、Ⅲ对应的水碳比最大是Ⅲ.
②测得B点氨的转化率为40%,则x13.
0 172345 172353 172359 172363 172369 172371 172375 172381 172383 172389 172395 172399 172401 172405 172411 172413 172419 172423 172425 172429 172431 172435 172437 172439 172440 172441 172443 172444 172445 172447 172449 172453 172455 172459 172461 172465 172471 172473 172479 172483 172485 172489 172495 172501 172503 172509 172513 172515 172521 172525 172531 172539 203614
Ⅰ.工业上合氨用的H2有多种制取的方法:
①用焦炭跟水反应:C(s)+H2O(g)$\frac{\underline{\;高温\;}}{\;}$CO(g)+H2(g);
②用天然气中水蒸气反应:CH4(g)+H2O(g)$\frac{\underline{\;催化剂\;}}{高温}$CO(g)+3H2(g)
已知有关反应的能量变化如图所示,且方法②的反应只能在高温下发生,则方法②中反应的△H=(a+3b-c)KJ/mol.

Ⅱ.在3个1L的密闭容器中,同温度下、使用相同催化剂分别进行反应:
3H2(g)+N2(g)$?_{催化剂}^{高温、高压}$2NH3(g),按不同方式设入反应物,保持恒温、恒容,反应达到平衡时有关数据为:
| 容器 | 甲 | 乙 | 丙 |
| 反应物投入量 | 3molH2、2molN2 | 6molH2、4molN2 | 2molNH3 |
| 达到平衡的时间(min) | T | 5 | 8 |
| 平衡时N2的浓度(mol•L-1) | C1 | 3 | |
| N2的体积分数 | ω1 | ω2 | ω3 |
| 混合气体密度(g•L-1) | ρ1 | ρ2 |
a.容器内N2、H2、NH3的浓度之比为1:3:2 b.v(N2)正=3v(H2)逆
c.容器内压强保持不变 d.混合气体的密度保持不变
(2)甲容器中达到平衡所需的时间t>5min(填“>”、“<”或“=”).
(3)乙中从反应开始到平衡时N2的平均反应速率0.2mol/(L.min),(注明单位).
(4)分析上表数据,下列关系正确的是c.
a.2c1=3mol/L b.ω1=ω2 c.2ρ1=ρ2
(5)该温度下,容器乙中,该反应的平衡常数K=$\frac{4}{81}$(用分数表示)(mol/L)-2.
Ⅲ.(1)有人设想以N2和H2为反应物,以溶有A的稀盐酸为电解质溶液,可制造出既能提供电能,又能固氮的新型燃料电池,装置如图1所示.

电池正极的电极反应式是N2+8H++6e-=2NH4+,A是氯化铵.
(2)用氨合成尿素的反应为2NH3(g)+CO2(g)?CO(NH2)2(s)+H2O(g).工业生产时,原料气带有水蒸气.图2表示CO2的转化率与氨碳比$\frac{n(N{H}_{3})}{n(C{O}_{2})}$、水碳比$\frac{n({H}_{2}O)}{n(C{O}_{2})}$的变化关系.
①曲线Ⅰ、Ⅱ、Ⅲ对应的水碳比最大是Ⅲ.
②测得B点氨的转化率为40%,则x13.
 在容积固定的2L密闭容器中,一定条件下发生如下反应:X(g)+2Y(g)?nZ(g),反应过程中各物质的量与时间的关系如图所示.完成下列填空:
在容积固定的2L密闭容器中,一定条件下发生如下反应:X(g)+2Y(g)?nZ(g),反应过程中各物质的量与时间的关系如图所示.完成下列填空: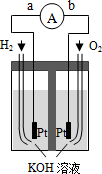 氢氧燃料电池是符合绿色化学理念的新型发电装置.如图为电池示意图.该电池电池表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定,请回答:
氢氧燃料电池是符合绿色化学理念的新型发电装置.如图为电池示意图.该电池电池表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定,请回答: