题目内容
15.将气体A、B置于容积为2L的密闭容器中,发生如下反应:3A(g)+B(g)?2C(g)+D(g),反应进行到10s末,测得A的物质的量为1.8mol,B的物质的量为0.6mol,C的物质的量浓度0.4mol.L-1,则:(1)用反应物B的浓度改变来表示该反应的速率为0.02mol/(L.s).
(2)反应前A的物质的量浓度是1.5mol/L.
(3)1s末,混合气体的密度不变不能(能或不能)说明反应达到平衡.
分析 (1)先计算C的平均反应速率,再根据同一方程式中同一时间内各物质的反应速率之比等于其计量数之比计算B的反应速率;
(2)10s末C的n(C)=0.4mol/L×2L=0.8mol,根据方程式知,参加反应的n(A)=$\frac{3}{2}$n(C)=$\frac{3}{2}$×0.8mol=1.2mol,反应前A的物质的量=1.8mol+1.2mol=3mol,根据C=$\frac{n}{V}$计算反应前A的物质的量浓度;
(3)反应前后气体质量不变,容器体积不变,所以反应前后气体密度始终不变,只有反应前后改变的物理量才能作为判断平衡状态的依据.
解答 解:(1)v(C)=$\frac{0.4mol/L}{10s}$=0.04mol/(L.s),根据同一方程式中同一时间内各物质的反应速率之比等于其计量数之比得v(B)=$\frac{1}{2}$v(C)=$\frac{1}{2}$×0.04mol/(L.s)=0.02mol/(L.s),
故答案为:0.02mol/(L.s);
(2)10s末C的n(C)=0.4mol/L×2L=0.8mol,根据方程式知,参加反应的n(A)=$\frac{3}{2}$n(C)=$\frac{3}{2}$×0.8mol=1.2mol,反应前A的物质的量=1.8mol+1.2mol=3mol,C(A)=$\frac{n}{V}$=$\frac{3mol}{2L}$=1.5mol/L,
故答案为:1.5mol/L;
(3)反应前后气体质量不变,容器体积不变,所以反应前后气体密度始终不变,只有反应前后改变的物理量才能作为判断平衡状态的依据,反应前后密度始终不变,所以不能根据密度判断平衡状态,故答案为:不能.
点评 本题考查化学平衡有关计算,为高频考点,明确各个物理量关系是解本题关键,只有反应前后改变的物理量才能作为判断平衡状态的依据,题目难度不大.

| A. | 油与脂肪 | B. | 淀粉与纤维素 | C. | 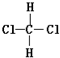 和 和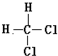 | D. | 正丁烷和异丁烷 |
| A. | 等物质的量的N2与O2中的所含分子数均为NA | |
| B. | 标准状况下,5.6L CCl4含有的分子数为0.25NA | |
| C. | 常温常压下,22gCO2含有的原子数为1.5NA | |
| D. | 1mol/L NaOH溶液中含有的Na+的数目为NA |
| A. | Q一定是氧化剂 | |
| B. | 当有1 mol O2生成时转移电子4 mol | |
| C. | O2一定是氧化产物 | |
| D. | Na2O2不可能发生还原反应 |
| A. | 铁片与稀盐酸制取氢气时,加入NaNO3固体或Na2SO4固体都不影响生成氢气的速率 | |
| B. | 等质量的锌片分别与同体积、同物质的量浓度的盐酸、硫酸反应,反应速率不相等 | |
| C. | SO2的催化氧化是一个放热反应,所以升高温度,反应速率减慢 | |
| D. | 加入反应物,单位体积内活化分子百分数增大,化学反应速率增大 |
 已知:溴苯的熔点为?30.8℃,沸点156℃.实验室用苯和液溴制取溴苯的装置如图:
已知:溴苯的熔点为?30.8℃,沸点156℃.实验室用苯和液溴制取溴苯的装置如图: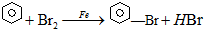 .;
.;