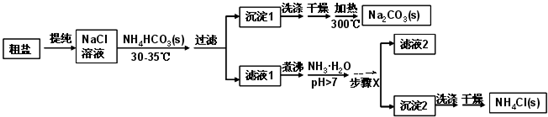
题目内容
19.化学在生产和日常生活中有着重要的应用.下列说法错误的是( )| A. | 过氧化钠可用于食品、羽毛和织物等的漂白 | |
| B. | 含盐腌制品不宜直接存放在铝制容器中 | |
| C. | 燃放烟花是利用了某些金属元素的焰色反应 | |
| D. | 铝比铁活泼,但铝制品比铁制品在空气中耐腐蚀 |
分析 A.过氧化钠可用作呼吸面具中的供氧剂;
B.氧化铝为致命的结构,但氯离子存在时,结构被破坏;
C.金属元素发生焰色反应会出现不同的色彩;
D.Al比铁活泼,但氧化铝为致密的氧化物.
解答 解:A.过氧化钠可用作呼吸面具中的供氧剂,不能用于食品、羽毛和织物等的漂白,故A错误;
B.氧化铝为致命的结构,但氯离子存在时,结构被破坏,所以含盐腌制品不宜直接放在铝制容器中,故B正确;
C.金属元素发生焰色反应会出现不同的色彩,节日燃放的烟花即是某些金属元素发生焰色反应所呈现出来的色彩,故C正确;
D.Al比铁活泼,但氧化铝为致密的氧化物,所以铝制品比铁制品在空气中耐腐蚀,故D正确;
故选A.
点评 本题考查物质的性质和用途等,综合性较强,涉及过氧化钠、氧化铝的性质、焰色反应的性质等,注重基础知识的考查,题目难度不大.

练习册系列答案
 考前必练系列答案
考前必练系列答案
相关题目
13.对于制氢气原理CH4(g)+H2O(g)═CO(g)+3H2(g)△H=+206.4kJ•mol-1,一定可以提高平衡体系中H2百分含量,又能加快反应速率的措施是( )
| A. | 降低压强 | B. | 增大水蒸气浓度 | C. | 加入催化剂 | D. | 升高温度 |
14.氨的合成是最重要的化工生产之一.
Ⅰ.工业上合氨用的H2有多种制取的方法:
①用焦炭跟水反应:C(s)+H2O(g)$\frac{\underline{\;高温\;}}{\;}$CO(g)+H2(g);
②用天然气中水蒸气反应:CH4(g)+H2O(g)$\frac{\underline{\;催化剂\;}}{高温}$CO(g)+3H2(g)
已知有关反应的能量变化如图所示,且方法②的反应只能在高温下发生,则方法②中反应的△H=(a+3b-c)KJ/mol.

Ⅱ.在3个1L的密闭容器中,同温度下、使用相同催化剂分别进行反应:
3H2(g)+N2(g)$?_{催化剂}^{高温、高压}$2NH3(g),按不同方式设入反应物,保持恒温、恒容,反应达到平衡时有关数据为:
(1)下列能说明该反应已达到平衡状态的是c.
a.容器内N2、H2、NH3的浓度之比为1:3:2 b.v(N2)正=3v(H2)逆
c.容器内压强保持不变 d.混合气体的密度保持不变
(2)甲容器中达到平衡所需的时间t>5min(填“>”、“<”或“=”).
(3)乙中从反应开始到平衡时N2的平均反应速率0.2mol/(L.min),(注明单位).
(4)分析上表数据,下列关系正确的是c.
a.2c1=3mol/L b.ω1=ω2 c.2ρ1=ρ2
(5)该温度下,容器乙中,该反应的平衡常数K=$\frac{4}{81}$(用分数表示)(mol/L)-2.
Ⅲ.(1)有人设想以N2和H2为反应物,以溶有A的稀盐酸为电解质溶液,可制造出既能提供电能,又能固氮的新型燃料电池,装置如图1所示.
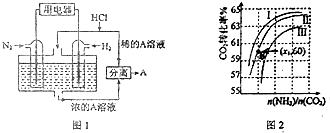
电池正极的电极反应式是N2+8H++6e-=2NH4+,A是氯化铵.
(2)用氨合成尿素的反应为2NH3(g)+CO2(g)?CO(NH2)2(s)+H2O(g).工业生产时,原料气带有水蒸气.图2表示CO2的转化率与氨碳比$\frac{n(N{H}_{3})}{n(C{O}_{2})}$、水碳比$\frac{n({H}_{2}O)}{n(C{O}_{2})}$的变化关系.
①曲线Ⅰ、Ⅱ、Ⅲ对应的水碳比最大是Ⅲ.
②测得B点氨的转化率为40%,则x13.
Ⅰ.工业上合氨用的H2有多种制取的方法:
①用焦炭跟水反应:C(s)+H2O(g)$\frac{\underline{\;高温\;}}{\;}$CO(g)+H2(g);
②用天然气中水蒸气反应:CH4(g)+H2O(g)$\frac{\underline{\;催化剂\;}}{高温}$CO(g)+3H2(g)
已知有关反应的能量变化如图所示,且方法②的反应只能在高温下发生,则方法②中反应的△H=(a+3b-c)KJ/mol.

Ⅱ.在3个1L的密闭容器中,同温度下、使用相同催化剂分别进行反应:
3H2(g)+N2(g)$?_{催化剂}^{高温、高压}$2NH3(g),按不同方式设入反应物,保持恒温、恒容,反应达到平衡时有关数据为:
| 容器 | 甲 | 乙 | 丙 |
| 反应物投入量 | 3molH2、2molN2 | 6molH2、4molN2 | 2molNH3 |
| 达到平衡的时间(min) | T | 5 | 8 |
| 平衡时N2的浓度(mol•L-1) | C1 | 3 | |
| N2的体积分数 | ω1 | ω2 | ω3 |
| 混合气体密度(g•L-1) | ρ1 | ρ2 |
a.容器内N2、H2、NH3的浓度之比为1:3:2 b.v(N2)正=3v(H2)逆
c.容器内压强保持不变 d.混合气体的密度保持不变
(2)甲容器中达到平衡所需的时间t>5min(填“>”、“<”或“=”).
(3)乙中从反应开始到平衡时N2的平均反应速率0.2mol/(L.min),(注明单位).
(4)分析上表数据,下列关系正确的是c.
a.2c1=3mol/L b.ω1=ω2 c.2ρ1=ρ2
(5)该温度下,容器乙中,该反应的平衡常数K=$\frac{4}{81}$(用分数表示)(mol/L)-2.
Ⅲ.(1)有人设想以N2和H2为反应物,以溶有A的稀盐酸为电解质溶液,可制造出既能提供电能,又能固氮的新型燃料电池,装置如图1所示.

电池正极的电极反应式是N2+8H++6e-=2NH4+,A是氯化铵.
(2)用氨合成尿素的反应为2NH3(g)+CO2(g)?CO(NH2)2(s)+H2O(g).工业生产时,原料气带有水蒸气.图2表示CO2的转化率与氨碳比$\frac{n(N{H}_{3})}{n(C{O}_{2})}$、水碳比$\frac{n({H}_{2}O)}{n(C{O}_{2})}$的变化关系.
①曲线Ⅰ、Ⅱ、Ⅲ对应的水碳比最大是Ⅲ.
②测得B点氨的转化率为40%,则x13.
11.在一定温度下,在容积恒定的密闭容器中发生反应:2A(s)+2B(g)?C(g)+D(g)当下列物理量不发生变化时,能说明该反应已达到平衡状态的是( )
①混合气体平均相对分子质量 ②容器内气体压强 ③混合气体总物质的量 ④C物质的量浓度.
①混合气体平均相对分子质量 ②容器内气体压强 ③混合气体总物质的量 ④C物质的量浓度.
| A. | 只有②③ | B. | ①④ | C. | ②③④ | D. | 只有④ |
8.如表根据实验操作和现象所得出的结论错误的是( )
| 选 项 | 实验操作 | 实验现象 | 结论 |
| A | 取久置的Na2O2粉末,向其中滴加过量的盐酸 | 产生无色气体 | Na2O2没有完全变质 |
| B | 将少量的溴水滴入FeCl2、NaI的混合溶液中,再滴加CCl4,振荡、静置,向上层溶液中滴加KSCN溶液.再向上层溶液中滴加溴水 | 实验现象1: 上层溶液不变红,下层溶液呈紫红色 实验现象2: 上层溶液变红 | 氧化性:Br2>Fe3+>I2 |
| C | 将一片铝箔置于酒精灯外焰上灼烧 | 铝箔熔化但不滴落 | 铝箔表面有致密Al2O3薄膜,且Al2O3熔点高于Al的 |
| D | 取久置的绿矾(FeSO4•7H2O)溶于水,加入KSCN溶液 | 溶液变为红色 | 绿矾部分或全部被氧化 |
| A. | A | B. | B | C. | C | D. | D |