5.合成气(CO+H2)是一种重要的化工原料,在化工生产中具有十分广泛的用途.下图是以天然气为主要原料制备合成气,并用合成气生产甲醇和二甲醚(CH3OCH3)及炼铁的一种工艺流程:
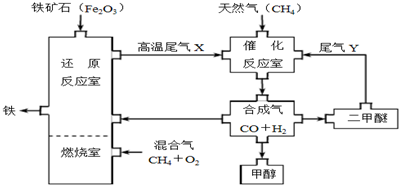
(1)在用合成气炼铁的流程中,向燃烧室通入甲烷与氧气的最佳体积配比V(CH4):V(O2)为1:2.
(2)尾气Y的成分与合成气的配比有关,则合成二甲醚时所发生的反应可能有2CO+4H2=CH3OCH3+H2O、3CO+3H2=CH3OCH3+CO2.
(3)在催化反应室中所发生的反应为可逆反应,则低压(填“高压”或“低压”)有利于合成气的合成.
(4)以Cu2O/ZnO为催化剂,由合成气合成甲醇可在一定温度和压强下自发进行,则反应:CO(g)+2H2(g)?CH3OH(g)在高温、低压条件下一定不能自发进行.为探究合成甲醇的适宜温度和压强,某同学设计了如下三组实验:
则T1=250,P1=5.

(1)在用合成气炼铁的流程中,向燃烧室通入甲烷与氧气的最佳体积配比V(CH4):V(O2)为1:2.
(2)尾气Y的成分与合成气的配比有关,则合成二甲醚时所发生的反应可能有2CO+4H2=CH3OCH3+H2O、3CO+3H2=CH3OCH3+CO2.
(3)在催化反应室中所发生的反应为可逆反应,则低压(填“高压”或“低压”)有利于合成气的合成.
(4)以Cu2O/ZnO为催化剂,由合成气合成甲醇可在一定温度和压强下自发进行,则反应:CO(g)+2H2(g)?CH3OH(g)在高温、低压条件下一定不能自发进行.为探究合成甲醇的适宜温度和压强,某同学设计了如下三组实验:
| 实验编号 | n(H 2)/n(CO) | T/℃ | P/MPa |
| i | m1 | 250 | 1 |
| ii | 3 | T1 | 5 |
| iii | m2 | 350 | P1 |
3.碳和氮是动植物体中的重要组成元素,向大气中过度排放二氧化碳会造成温室效应,氮氧化物会产生光化学烟雾,目前,这些有毒有害气体的处理成为科学研究的重要内容.
(1)用活性炭还原法处理氮氧化物.有关反应为:C(s)+2NO(g)?N2(g)+CO2(g).
某研究小组向一个容器容积为3L且容积不变的密闭真空容器(固体试样体积忽略不计)中加入NO和足量的活性炭,在恒温(T1℃)条件下反应,测得不同时间(t)时各物质的物质的量(n)如表:
①0min~10min以v(N2)表示的反应速率为0.014mol/(L•min).
②根据表中数据,计算T1℃时该反应的平衡常数为0.56(保留两位小数).若某一时刻,容器中有1.2molC、1.2molNO、0.75molN2和1.08molCO2,此时v(正)=v(逆)(填“>、<、=”)
③下列各项能判断该反应达到平衡状态的是AC(填序号字母).
A.v(NO)(正)=2v(N2)(逆) B.容器内CO2和N2的体积比为1:1
C.混合气体的平均相对分子质量保持不变 D.容器内压强保持不变
④一定温度下,随着NO的起始浓度增大,则NO的平衡转化率不变(填“增大”、“不变”或“减小”).
(2)将水蒸气通过红热的碳即可产生水煤气.已知:C(s)+H2O(g)?CO(g)+H2(g)△H=+131.3kJ•mol-1,C(s)+CO2(g)?2CO(g)△H=+172.5kJ•mol-1,则CO(g)+H2O(g)?CO2(g)+H2(g)的焓变△H=-41.2kJ•mol-1.
(3)在3L容积可变的密闭容器中发生上述反应:H2(g)+CO2(g)?H2O(g)+CO(g),恒温下c(CO)随反应时间t变化的曲线Ⅰ如图所示.
①若在t0时改变一个条件,使曲线Ⅰ变成曲线Ⅱ,则改变的条件是加入催化剂;

②若在t0时刻将容器体积快速压缩至2L(其他条件不变),请在图中画出c(CO)随反应时间t变化的曲线.
(1)用活性炭还原法处理氮氧化物.有关反应为:C(s)+2NO(g)?N2(g)+CO2(g).
某研究小组向一个容器容积为3L且容积不变的密闭真空容器(固体试样体积忽略不计)中加入NO和足量的活性炭,在恒温(T1℃)条件下反应,测得不同时间(t)时各物质的物质的量(n)如表:
| n/mol t/min | NO | N2 | CO2 |
| 0 | 2.00 | 0 | 0 |
| 10 | 1.16 | 0.42 | 0.42 |
| 20 | 0.80 | 0.60 | 0.60 |
| 30 | 0.80 | 0.60 | 0.60 |
②根据表中数据,计算T1℃时该反应的平衡常数为0.56(保留两位小数).若某一时刻,容器中有1.2molC、1.2molNO、0.75molN2和1.08molCO2,此时v(正)=v(逆)(填“>、<、=”)
③下列各项能判断该反应达到平衡状态的是AC(填序号字母).
A.v(NO)(正)=2v(N2)(逆) B.容器内CO2和N2的体积比为1:1
C.混合气体的平均相对分子质量保持不变 D.容器内压强保持不变
④一定温度下,随着NO的起始浓度增大,则NO的平衡转化率不变(填“增大”、“不变”或“减小”).
(2)将水蒸气通过红热的碳即可产生水煤气.已知:C(s)+H2O(g)?CO(g)+H2(g)△H=+131.3kJ•mol-1,C(s)+CO2(g)?2CO(g)△H=+172.5kJ•mol-1,则CO(g)+H2O(g)?CO2(g)+H2(g)的焓变△H=-41.2kJ•mol-1.
(3)在3L容积可变的密闭容器中发生上述反应:H2(g)+CO2(g)?H2O(g)+CO(g),恒温下c(CO)随反应时间t变化的曲线Ⅰ如图所示.
①若在t0时改变一个条件,使曲线Ⅰ变成曲线Ⅱ,则改变的条件是加入催化剂;

②若在t0时刻将容器体积快速压缩至2L(其他条件不变),请在图中画出c(CO)随反应时间t变化的曲线.
1.t℃时,在体积不变的密闭容器中发生反应:X(g)+3Y(g)?2Z(g),各组分在不同时刻的浓度如表:下列说法正确的是( )
| 物质 | X | Y | Z |
| 初始浓度/mol•L-1 | 0.1 | 0.2 | 0 |
| 2min末浓度/mol•L-1 | 0.08 | a | b |
| 平衡浓度/mol•L-1 | 0.05 | 0.05 | 0.1 |
| A. | 平衡时,X的转化率为20% | |
| B. | t℃时,该反应的平衡常数为40 | |
| C. | 前2 min内,用Y的变化量表示的平均反应速率v(Y)=0.03 mol•L-1•min-1 | |
| D. | 增大平衡后的体系压强,v正增大,v逆减小,平衡向正反应方向移动 |
20.已知,T℃时2A(g)+B(g)?2C(g)△H=-akJ/mol(a>0),在甲、乙、丙三个容积均为2L的恒容密闭容器中投入A(g)和B(g),经5min达到平衡.其起始物质的量及A的平衡转化率如表所示.
下列判断中,错误的是( )
| 甲 | 乙 | 丙 | ||
| 起始物质的量 | n(A)/mol | 0.4 | 0.8 | 0.8 |
| n(B)/mol | 0.24 | 0.24 | 0.48 | |
| A的平衡转化率 | 80% | α1 | α2 | |
| A. | 甲从开始到平衡时ν(A)为0.032mol•L-1•min-1 | |
| B. | 平衡时,A的转化率:α1<80%<α2 | |
| C. | T℃时,平衡常数K=400L/mol | |
| D. | 绝热容器中,压缩体积,平衡常数K>400 L/mol |
18. 碳素利用是环保科学家研究的热点课题.
碳素利用是环保科学家研究的热点课题.
I.某研究小组现将三组CO(g)与H2O(g)的混合气体分别通入体积为2L的恒容密闭容器中,一定条件下发生反应:CO(g)+H2O(g)?CO2(g)+H2(g)△H<0,得到如表数据:
(1)实验I中,前5min的反应速率υ(CO2)=0.1mol/(L.min).
(2)下列能判断在800℃实验条件下CO(g)与H2O(g)反应一定达到平衡状态的是BD.
A.容器内压强不再变化 B.n2(H2)=n(H2O)•n(CO)
C.混合气体密度不变 D.υ正(CO)=υ逆(CO2)
(3)实验II和III中CO的平衡转化率:αII(CO)>αIII(CO) (填:>、<或=,下同),T1>T2,a=$\sqrt{3}$-1(填精确数值).
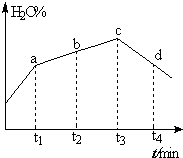
(4)若实验Ⅲ的容器改为在绝热的密闭容器中进行,实验测得H2O(g)的转化率随时间变化的示意图如图所示,b点υ正>υ逆(填“<”、“=”或“>”),t3~t4时刻,H2O(g)的转化率H2O%降低的原因是该反应达到平衡后,因反应为放热反应且反应容器为绝热容器,故容器内温度升高,反应逆向进行.
(5)CO和H2在一定条件下合成甲醇.甲醇/空气碱性燃料电池中,消耗32g甲醇,电池中有转移4.5mol电子.负极的电极反应式为CH3OH-6e-+8OH-=CO32-+6H2O.该电池中电流效率为75%.(电流效率η=$\frac{实际转移电子数}{理论转移电子数}$×100%)
 碳素利用是环保科学家研究的热点课题.
碳素利用是环保科学家研究的热点课题.I.某研究小组现将三组CO(g)与H2O(g)的混合气体分别通入体积为2L的恒容密闭容器中,一定条件下发生反应:CO(g)+H2O(g)?CO2(g)+H2(g)△H<0,得到如表数据:
| 实验组 | 温度/℃ | 起始量(mol) | 平衡量(mol) | 达到平衡所 需要时间/min | ||
| CO(g) | H2O(g) | CO2(g) | H2(g) | |||
| I | 800 | 2 | 2 | x | 1 | 5 |
| II | 900 | 1 | 2 | 0.5 | 0.5 | T1 |
| III | 900 | 2 | 2 | a | a | T2 |
(2)下列能判断在800℃实验条件下CO(g)与H2O(g)反应一定达到平衡状态的是BD.
A.容器内压强不再变化 B.n2(H2)=n(H2O)•n(CO)
C.混合气体密度不变 D.υ正(CO)=υ逆(CO2)
(3)实验II和III中CO的平衡转化率:αII(CO)>αIII(CO) (填:>、<或=,下同),T1>T2,a=$\sqrt{3}$-1(填精确数值).
(4)若实验Ⅲ的容器改为在绝热的密闭容器中进行,实验测得H2O(g)的转化率随时间变化的示意图如图所示,b点υ正>υ逆(填“<”、“=”或“>”),t3~t4时刻,H2O(g)的转化率H2O%降低的原因是该反应达到平衡后,因反应为放热反应且反应容器为绝热容器,故容器内温度升高,反应逆向进行.
(5)CO和H2在一定条件下合成甲醇.甲醇/空气碱性燃料电池中,消耗32g甲醇,电池中有转移4.5mol电子.负极的电极反应式为CH3OH-6e-+8OH-=CO32-+6H2O.该电池中电流效率为75%.(电流效率η=$\frac{实际转移电子数}{理论转移电子数}$×100%)
17.在2L恒容密闭容器中投入足量M(s)和一定量的R(g),发生反应为M(s)+R(g)?X(g)+Y(g)△H;所得实验数据如表所示:
下列推断正确的是( )
| 实验 | 温度/℃ | 起始时R的物质的量/mol | 平衡时气体总物质的量/mol |
| ① | 300 | 2.00 | 2.80 |
| ② | 400 | 2.00 | 3.00 |
| ③ | 400 | 4.00 | a |
| A. | 上述反应中,△H<0 | |
| B. | 实验②中,该反应的平衡常数K=0.5 | |
| C. | 实验①经4 min达到平衡,0~4 min内υ(X)=0.2mol•L-1•min-1 | |
| D. | 实验③中a=6.00 |
16.将E和F加入密闭容器中,在一定条件下发生反应:E(g)+F(s)═2G(g).忽略固体体积,平衡时G的体积分数(%)随温度和压强的变化如表所示,已知Kp是用平衡分压代替平衡浓度计算,分压=总压×物质的量分数,下列说法正确的是( )
0 172184 172192 172198 172202 172208 172210 172214 172220 172222 172228 172234 172238 172240 172244 172250 172252 172258 172262 172264 172268 172270 172274 172276 172278 172279 172280 172282 172283 172284 172286 172288 172292 172294 172298 172300 172304 172310 172312 172318 172322 172324 172328 172334 172340 172342 172348 172352 172354 172360 172364 172370 172378 203614
 | 1.0 | 2.0 | 3.0 |
| 810 | 54.0 | a | b |
| 915 | c | 75.0 | d |
| 1000 | e | f | 83.0 |
| A. | b>f | |
| B. | 平衡常数K(1000℃)<K(810℃) | |
| C. | 915℃,2.0MPa该反应的平衡常数为Kp=4.5MPa | |
| D. | 1000℃,3.0MPa时E的转化率为83% |
 Ⅰ.在某温度时按n(N2):n(H2)=1:3的比例将混合气体投入密闭容器中反应:N2(g)+3H2(g)═2NH3(g)△H<0;
Ⅰ.在某温度时按n(N2):n(H2)=1:3的比例将混合气体投入密闭容器中反应:N2(g)+3H2(g)═2NH3(g)△H<0;
