题目内容
17.在2L恒容密闭容器中投入足量M(s)和一定量的R(g),发生反应为M(s)+R(g)?X(g)+Y(g)△H;所得实验数据如表所示:| 实验 | 温度/℃ | 起始时R的物质的量/mol | 平衡时气体总物质的量/mol |
| ① | 300 | 2.00 | 2.80 |
| ② | 400 | 2.00 | 3.00 |
| ③ | 400 | 4.00 | a |
| A. | 上述反应中,△H<0 | |
| B. | 实验②中,该反应的平衡常数K=0.5 | |
| C. | 实验①经4 min达到平衡,0~4 min内υ(X)=0.2mol•L-1•min-1 | |
| D. | 实验③中a=6.00 |
分析 A.对照实验①和②知,温度升高,平衡体系中气体总物质的量增大,说明平衡向正反应方向移动;
B.平衡时,混合气体物质的量增大1mol,则转化的R为1mol,生成的X、Y均为1mol,故平衡时c(R)=0.5 mol•L-1,c(X)=0.5 mol•L-1,c(Y)=0.5 mol•L-1,平衡常数K=$\frac{c(X)•c(Y)}{c(R)}$;
C.平衡时,混合气体物质的量增大0.8mol,则达到平衡时生成了0.8 mol X,根据v=$\frac{△c}{△t}$计算υ(X);
D.实验②体积压缩至1L与实验③等效,加压时平衡向左移动,即X转化率降低,实验②中X转化率为50%,则实验③中X转化率小于50%.
解答 解:A.对照实验①和②知,温度升高,平衡体系中气体总物质的量增大,说明平衡向正反应方向移动,则正反应是吸热反应,即△H>0,故A错误;
B.平衡时,混合气体物质的量增大1mol,则转化的R为1mol,生成的X、Y均为1mol,故平衡时c(R)=0.5 mol•L-1,c(X)=0.5 mol•L-1,c(Y)=0.5 mol•L-1,则平衡常数K=$\frac{c(X)•c(Y)}{c(R)}$=$\frac{0.5×0.5}{0.5}$=0.5,故B正确;
C.平衡时,混合气体物质的量增大0.8mol,达到平衡时生成了0.8 mol X,则υ(X)=$\frac{0.8mol}{4min×2L}$=0.1 mol•L-1•min-1,故C错误;
D.实验②体积压缩至1L与实验③等效,加压时平衡向左移动,即X转化率降低,实验②中X转化率为50%,则实验③中X转化率小于50%,即a<6,故D错误,
故选:B.
点评 本题考查化学平衡有关计算,难度不大,D选项可以利用平衡常数计算具体的值,解答中利用等效平衡思想进行判断,避免计算繁琐.

| A. | 打断$\frac{a}{3}$mol的N-H键同时消耗$\frac{a}{6}$mol的尿素 | |
| B. | 密闭容器中混合气体的平均摩尔质量保持不变 | |
| C. | 密闭容器中混合气体的密度保持不变 | |
| D. | 密闭容器中二氧化碳的体积分数保持不变 |
①常温下NaNO2溶液pH大于7
②用HNO2溶液做导电实验,灯泡很暗
③HNO2和NaCl不能发生反应
④0.1mol•L-1HNO2溶液的pH=2.1
⑤NaNO2和H3PO4反应,生成HNO2
⑥0.1mol•L-1HNO2溶液稀释至100倍,pH约为3.1.
| A. | ①④⑥ | B. | ①②③④ | C. | ①④⑤⑥ | D. | 全部 |
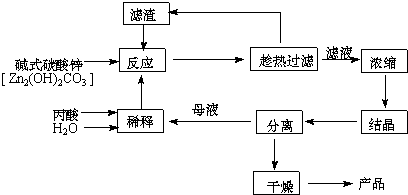
| 序号 | n(丙酸):n(碱式碳酸锌) | 反应 温度/℃ | 丙酸锌 产率/% |
| 1 | 1:0.25 | 60 | 67.2 |
| 2 | 1:0.25 | 80 | 83.5 |
| 3 | 1:0.25 | 100 | 81.4 |
| 4 | 1:0.31 | 60 | 89.2 |
| 5 | 1:0.31 | 80 | 90.1 |
| 6 | 1:0.31 | 100 | 88.8 |
(2)本题采用趁热过滤的方式,其目的是:防止醋酸锌结晶析出.
(3)实验中用水量不易过少,其原因是水的用量较少时,反应不易完全,且易造成丙酸挥发损失,不利于提高产率和产品的纯度.
(4)探究本实验中最佳工艺条件(见表):反应时间2h,用水量45g,n(丙酸):n(碱式碳酸锌)=1:0.31,反应温度80℃.
(5)某次实验时,将37.0g丙酸溶于220mL水中,按上述流程在上述优化的条件下制备,最终得产品丙酸锌49.6g,则该次实验丙酸锌的产率为:94.0%.
(6)本工艺“采用闭路循环”方式,除具有制备工艺简便、产率高外,还具有:原料利用率高,无废液、废渣排放.
| A. | 1s、2px、2py、2pz轨道都具有球对称性 | |
| B. | 因为p轨道是“8”字形的,所以p电子也是“8”字形 | |
| C. | 氢原子中只有一个电子,故氢原子只有一个轨道 | |
| D. | 原子轨道示意图与电子云图都是用来形象描述电子运动状态的图形 |


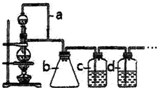 某学习小组拟以下列合成路线合成1-丁醇:CH3CH=CH2+CO+H2$\stackrel{一定条件}{→}$CH3CH2CH2CHO$→_{N/△}^{H_{2}}$CH3CH2CH2CH2OH
某学习小组拟以下列合成路线合成1-丁醇:CH3CH=CH2+CO+H2$\stackrel{一定条件}{→}$CH3CH2CH2CHO$→_{N/△}^{H_{2}}$CH3CH2CH2CH2OH