题目内容
4. Ⅰ.在某温度时按n(N2):n(H2)=1:3的比例将混合气体投入密闭容器中反应:N2(g)+3H2(g)═2NH3(g)△H<0;
Ⅰ.在某温度时按n(N2):n(H2)=1:3的比例将混合气体投入密闭容器中反应:N2(g)+3H2(g)═2NH3(g)△H<0;(1)在恒容条件下该反应达到化学平衡状态的依据是d(选填序号).
a.υ(H2):υ(N2)=3:1
b.n(N2):n(NH3)=1:2
c.c(H2):c(NH3)=3:2
d.容器内压强保持不变
(2)反应达到平衡后,某时刻改变下列条件a,在达到新平衡的过程中正反应速率始终增大.
a.升温 b.加压 c.增大c(N2) d.降低c(NH3)
(3)某科研小组探究在其他条件不变的情况下,改变起始物氢气的物质的量对合成NH3反应的影响.实验结果如图1所示:(图中T2和T1表示温度,n表示起始时H2的物质的量)
①图象中T2和T1的关系是:T2<T1(填“>”、“<”、“=”或“无法确定”).
②比较在a、b、c三点所处的平衡状态中,反应物N2的转化率最大的是c(填字母).
③若容器容积为1L,b点对应的n=0.15mol,测得平衡时H2的转化率为60%,则平衡时N2的物质的量浓度为0.02 mol•L-1.
Ⅱ.常温时向浓度为0.1mol/L体积为VL的氨水中逐滴加入一定浓度的盐酸,用pH计测得溶液的pH随盐酸的加入量而降低的滴定曲线,d点两种溶液恰好完全反应.根据图2图象回答下列问题:
(1)比较b、c、d三点时的溶液中,水电离的c(OH-)由大到小的顺序为d>c>b.
(2)滴定时,由b点到c点的过程中,下列各选项中数值保持不变的有cd.
a.$\frac{c(NH4+)}{c(NH3•H2O)}$ b.$\frac{c(H+)}{c(OH-)}$c.$\frac{c(NH4+)•c(OH-)}{c(NH3•H2O)}$d.$\frac{c(NH3•H2O)•c(H+)}{c(NH4+)}$
(3)该温度时氨水的电离平衡常数K=10-5.
分析 I.(1)a.没有明确正逆速率,不能确定是否处于平衡状态;
b.平衡时氮气、氨气的物质的量关系与氮气的转化率有关;
c.平衡时氢气、氨气的浓度关系与氢气转化率有关;
d.正反应为气体物质的量减小的反应,随反应进行,压强减小,容器内压强保持不变说明到达平衡;
(2)a.升温温度,瞬间正逆速率都增大,正反应为放热反应,逆反应速率增大较大,平衡向逆反应移动,逆反应速率减小、正反应速率增大至平衡;
b.若通入稀有气体加压,反应速率不变;
c.增大c(N2),瞬间正反应增大、逆反应速率不变,平衡正向移动,正反应速率减小、逆反应速率增大到平衡状态;
d.降低c(NH3),瞬间正反应速率不变,逆反应速率减小,平衡正向移动,正反应速率减小、逆反应速率增大到平衡状态;
(3)①由图可知,n(H2)相同时,温度T2对应氨气含量高,反应为放热反应,降低温度有利于生成氨气;
②a、b、c三点,n(H2)越大,平衡正向移动的程度越大,N2的转化率越大;
③n=0.15molH2,起始体系中加入0.05molN2,反应达到平衡时H2的转化率为60%,则转化的氢气为0.09mol,则:
N2(g)+3H2(g)?2NH3(g)
开始(mol):0.05 0.15 0
变化(mol):0.03 0.09 0.06
平衡(mol):0.02 0.06 0.06
进而计算氮气的平衡浓度;
Ⅱ.(1)在b点时,溶质为氨水和氯化铵,氨水的电离程度大于氯化铵的水解程度,溶液为碱性,对水的电离平衡起到抑制作用,在c点时,溶质为氨水和氯化铵,氨水的电离程度等于于氯化铵的水解程度,溶液为中性,对水的电离平衡无影响,在d点时,溶质为氯化铵,氯化铵发生水解,溶液为酸性,对水的电离平衡促进;
(2)滴定时,由b点到c点的过程中,碱性减弱,酸性增强,
a.$\frac{c(NH4+)}{c(NH3•H2O)}$=$\frac{{K}_{b}(N{H}_{3}.{H}_{2}O)}{c(O{H}^{-})}$;
b.由b点到c点的过程中,c(H+)不断增大,c(OH-)不断减小;
c.$\frac{c(NH4+)•c(OH-)}{c(NH3•H2O)}$为一水合氨的电离平衡常数,只与温度有关;
d.$\frac{c(NH3•H2O)•c(H+)}{c(NH4+)}$是铵根离子水解平衡常数,只与温度有关;
(3)未加HCl时,氨水浓度为0.1mol/L,溶液的pH=11,则溶液中c(OH-)=$\frac{1{0}^{-14}}{1{0}^{-11}}$mol/L=0.001mol/L,水的电离程度较小,溶液中c(OH-)≈c(NH4+),一水合氨电离程度较小,则c(NH3.H2O)≈0.1mol/L,代入氨水的电离平衡常数K=$\frac{c(NH4+)•c(OH-)}{c(NH3•H2O)}$计算.
解答 解:I.(1)a.没有明确正逆速率,不能确定是否处于平衡状态,若分别为正逆速率则处于平衡状态,故a错误;
b.平衡时氮气、氨气的物质的量关系与氮气的转化率有关,平衡时可能为1:2,也可能不是1:2,故b错误;
c.平衡时氢气、氨气的浓度关系与氢气转化率有关,故c错误;
d.正反应为气体物质的量减小的反应,随反应进行,压强减小,容器内压强保持不变说明到达平衡,故d正确,
故选:d;
(2)a.升温温度,瞬间正逆速率都增大,正反应为放热反应,逆反应速率增大较大,平衡向逆反应移动,逆反应速率减小、正反应速率增大至平衡,在达到新平衡的过程中正反应速率始终增大,故a符合;
b.若通入稀有气体加压,反应速率不变,故b不符合;
c.增大c(N2),瞬间正反应增大、逆反应速率不变,平衡正向移动,正反应速率减小、逆反应速率增大到平衡状态,故c不符合;
d.降低c(NH3),瞬间正反应速率不变,逆反应速率减小,平衡正向移动,正反应速率减小、逆反应速率增大到平衡状态,故d不符合,
故选:a;
(3)①由图可知,n(H2)相同时,温度T2对应氨气含量高,反应为放热反应,降低温度有利于生成氨气,则T2<T1 ,故答案为:<;
②a、b、c三点,n(H2)越大,平衡正向移动的程度越大,N2的转化率越大,c点时氢气的物质的量最大,c点N2的转化率最高,故答案为:c;
③n=0.15molH2,起始体系中加入0.05molN2,反应达到平衡时H2的转化率为60%,则转化的氢气为0.09mol,则:
N2(g)+3H2(g)?2NH3(g)
开始(mol):0.05 0.15 0
变化(mol):0.03 0.09 0.06
平衡(mol):0.02 0.06 0.06
故氮气的平衡浓度为$\frac{0.02mol}{1L}$=0.02mol/L,故答案为:0.02;
Ⅱ.(1)在b点时,溶质为氨水和氯化铵,氨水的电离程度大于氯化铵的水解程度,溶液为碱性,对水的电离平衡起到抑制作用,在c点时,溶质为氨水和氯化铵,氨水的电离程度等于于氯化铵的水解程度,溶液为中性,对水的电离平衡无影响,在d点时,溶质为氯化铵,氯化铵发生水解,溶液为酸性,对水的电离平衡促进,所以b、c、d三点时的溶液中,水电离的c(OH-)大小顺序为:d>c>b,
故答案为:d>c>b;
(2)滴定时,由b点到c点的过程中,碱性减弱,酸性增强,
a.$\frac{c(NH4+)}{c(NH3•H2O)}$=$\frac{{K}_{b}(N{H}_{3}.{H}_{2}O)}{c(O{H}^{-})}$,由b点到c点的过程中,c(OH-)不断减小,故该值增大,故a不符合;
b.由b点到c点的过程中,c(H+)不断增大,c(OH-)不断减小,$\frac{c(H+)}{c(OH-)}$的值逐渐减小,故b不符合;
c.$\frac{c(NH4+)•c(OH-)}{c(NH3•H2O)}$为一水合氨的电离平衡常数,只与温度有关,滴定过程中不变,故c符合;
d.$\frac{c(NH3•H2O)•c(H+)}{c(NH4+)}$是铵根离子水解平衡常数,只与温度有关,滴定过程中不变,故d符合;
故选:cd;
(3)未加HCl时,氨水浓度为0.1mol/L,溶液的pH=11,则溶液中c(OH-)=$\frac{1{0}^{-14}}{1{0}^{-11}}$mol/L=0.001mol/L,水的电离程度较小,溶液中c(OH-)≈c(NH4+),一水合氨电离程度较小,则c(NH3.H2O)≈0.1mol/L,氨水的电离平衡常数K=$\frac{c(NH4+)•c(OH-)}{c(NH3•H2O)}$=$\frac{1{0}^{-3}×1{0}^{-3}}{0.1}$=10-5,
故答案为:10-5.
点评 本题考查化学平衡状态的判断、化学平衡的移动、化学平衡的计算、弱电解质的电离、滴定曲线、电离平衡常数的计算等知识点,是对学生综合能力的考查,题目难度中等.

 阅读快车系列答案
阅读快车系列答案| A. | 玻璃棒下端要靠在三层滤纸处 | |
| B. | 滤纸边缘低于漏斗边缘,多余部分要剪去,并用水湿润贴紧 | |
| C. | 过滤时,为了加快过滤速度,可用玻璃棒不断搅拌 | |
| D. | 加热蒸发时,使用酒精灯的外焰加热 |
| A. | 加入KSCN溶液变红色的溶液:NH4+、K+、I-、SO42- | |
| B. | 在pH=11的溶液中:Na+、AlO2-、NO3-、S2-、SO32- | |
| C. | 由水电离的c(OH-)=10-13mol•L-1的溶液中:Na+、Cl-、HCO3-、NO3- | |
| D. | 使甲基橙变红色的溶液:Fe2+、K+、SO42-、NO3- |
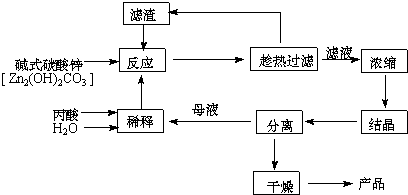
| 序号 | n(丙酸):n(碱式碳酸锌) | 反应 温度/℃ | 丙酸锌 产率/% |
| 1 | 1:0.25 | 60 | 67.2 |
| 2 | 1:0.25 | 80 | 83.5 |
| 3 | 1:0.25 | 100 | 81.4 |
| 4 | 1:0.31 | 60 | 89.2 |
| 5 | 1:0.31 | 80 | 90.1 |
| 6 | 1:0.31 | 100 | 88.8 |
(2)本题采用趁热过滤的方式,其目的是:防止醋酸锌结晶析出.
(3)实验中用水量不易过少,其原因是水的用量较少时,反应不易完全,且易造成丙酸挥发损失,不利于提高产率和产品的纯度.
(4)探究本实验中最佳工艺条件(见表):反应时间2h,用水量45g,n(丙酸):n(碱式碳酸锌)=1:0.31,反应温度80℃.
(5)某次实验时,将37.0g丙酸溶于220mL水中,按上述流程在上述优化的条件下制备,最终得产品丙酸锌49.6g,则该次实验丙酸锌的产率为:94.0%.
(6)本工艺“采用闭路循环”方式,除具有制备工艺简便、产率高外,还具有:原料利用率高,无废液、废渣排放.
| A. | Na2O2可作为潜艇工作人员的供氧剂 | |
| B. | 电解熔融NaCl可制得Na单质 | |
| C. | Fe3O4通常作为油漆原料 | |
| D. | 可用Ba(OH)2溶液区别NaHCO3溶液和Na2CO3溶液 |

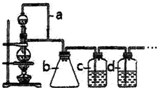 某学习小组拟以下列合成路线合成1-丁醇:CH3CH=CH2+CO+H2$\stackrel{一定条件}{→}$CH3CH2CH2CHO$→_{N/△}^{H_{2}}$CH3CH2CH2CH2OH
某学习小组拟以下列合成路线合成1-丁醇:CH3CH=CH2+CO+H2$\stackrel{一定条件}{→}$CH3CH2CH2CHO$→_{N/△}^{H_{2}}$CH3CH2CH2CH2OH

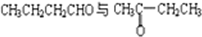 B.
B.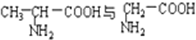 C.
C.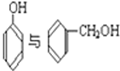 D.CH3CH2C≡CH与CH2═CH-CH═CH2E.
D.CH3CH2C≡CH与CH2═CH-CH═CH2E.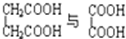 F.戊烯和戊烷
F.戊烯和戊烷 表示的分子式C6H14结构简式CH3CH(CH3)CH2CH2CH3,名称是2-甲基戊烷.
表示的分子式C6H14结构简式CH3CH(CH3)CH2CH2CH3,名称是2-甲基戊烷.