题目内容
20.已知,T℃时2A(g)+B(g)?2C(g)△H=-akJ/mol(a>0),在甲、乙、丙三个容积均为2L的恒容密闭容器中投入A(g)和B(g),经5min达到平衡.其起始物质的量及A的平衡转化率如表所示.| 甲 | 乙 | 丙 | ||
| 起始物质的量 | n(A)/mol | 0.4 | 0.8 | 0.8 |
| n(B)/mol | 0.24 | 0.24 | 0.48 | |
| A的平衡转化率 | 80% | α1 | α2 | |
| A. | 甲从开始到平衡时ν(A)为0.032mol•L-1•min-1 | |
| B. | 平衡时,A的转化率:α1<80%<α2 | |
| C. | T℃时,平衡常数K=400L/mol | |
| D. | 绝热容器中,压缩体积,平衡常数K>400 L/mol |
分析 A.平衡时A的转化率为80%,则A的浓度变化量为$\frac{0.4mol×80%}{2L}$=0.16mol/L,再根据v=$\frac{△c}{△t}$计算;
B.乙与甲相比,等效为在甲平衡的基础上加入0.4molA,A的转化率比甲中的小,而丙等效为在甲的基础压强增大一倍,平衡正向移动,A的转化率大于甲中;
C.甲中平衡时,平衡时A的转化率为80%,转化的A为0.4mol×80%=0.32mol,则:
2A(g)+B(g)?2C(g)
起始量(mol):0.4 2.4 0
变化量(mol):0.32 0.16 0.32
平衡量(mol):0.08 0.08 0.32
再根据K=$\frac{{c}^{2}(C)}{{c}^{2}(A)×c(B)}$计算平衡常数;
D.绝热容器中,压缩体积,压强增大,平衡正向移动,正反应为放热反应,体系温度升高,又使平衡逆向移动,平衡常数减小.
解答 解:A.平衡时A的转化率为80%,则A的浓度变化量为$\frac{0.4mol×80%}{2L}$=0.16mol/L,甲从开始到平衡时ν(A)=$\frac{0.16mol}{5min}$=0.032mol•L-1•min-1,故A正确;
B.乙与甲相比,等效为在甲平衡的基础上加入0.4molA,A的转化率比甲中的小,而丙等效为在甲的基础压强增大一倍,平衡正向移动,A的转化率大于甲中,则平衡时A的转化率:α1<80%<α2,故B正确;
C.甲中平衡时,平衡时A的转化率为80%,转化的A为0.4mol×80%=0.32mol,则:
2A(g)+B(g)?2C(g)
起始量(mol):0.4 2.4 0
变化量(mol):0.32 0.16 0.32
平衡量(mol):0.08 0.08 0.32
故平衡常数K=$\frac{{c}^{2}(C)}{{c}^{2}(A)×c(B)}$=$\frac{(\frac{0.32}{2})^{2}}{(\frac{0.08}{2})^{2}×\frac{0.08}{2}}$=400,故C正确;
D.绝热容器中,压缩体积,压强增大,平衡正向移动,正反应为放热反应,体系温度升高,又使平衡逆向移动,平衡常数减小,则绝热容器中,压缩体积,平衡常数K<400 L/mol,故D错误,
故选:D.
点评 本题考查化学平衡计算、反应速率计算、化学平衡影响因素、平衡常数计算等,B中注意利用等效思想根据平衡建立的途径,难度中等.

 名校名师培优作业本加核心试卷系列答案
名校名师培优作业本加核心试卷系列答案 全程金卷系列答案
全程金卷系列答案| A. | 氯化钠溶液 | B. | 苛性钠溶液 | C. | 硝酸银溶液 | D. | 碳酸钠溶液 |
| A. | 氢氧化铝可作胃酸过多的中和剂 | |
| B. | 为了防止中秋月饼等富脂食品氧化变质,延长食品保质期,在包装袋中常放入生石灰 | |
| C. | “加碘食盐”、“含氟牙膏”、“富硒营养品”、“高钙牛奶”、“加铁酱油”等等,这里的碘、氟、硒指的是对应的单质分子,而钙、铁则指的是对应的钙离子和铁离子 | |
| D. | PM2.5是指大气中直径接近2.5微米的颗粒物,入肺影响健康,这种颗粒物分散空气中形成胶体,它具有丁达尔现象 |
| 序号 | ① | ② | ③ | ④ | ⑤ | ⑥ |
| 仪器及装置图 | 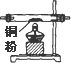 |  |  |  |  |  |
(1)如果所制得气体从左向右流向时,上述各仪器装置的正确连接顺序是(填各装置的序号)
③接⑤接④接②接①接⑥;其中,②与④装置相连时,玻璃管接口(用装置中字母表示)应是接C.
(2)装置⑥中发生反应的离子方程式是Cl2+2OH-=Cl-+ClO-+H2O.
(3)实验开始时,应首先检验装置的气密性;实验结束时,应先熄灭①处的酒精灯.
(4)在装置⑤的烧瓶中,发生反应的化学方程式为MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2+2H2O
(5)待充分反应后,装置①的玻璃管中呈棕黄色.冷却后,将制得的产物配成溶液,溶液呈绿(或蓝绿)色.
(6)若反应中有71gCl2生成,则被氧化的HCl的物质的量为2mol,转移电子数为2NA.
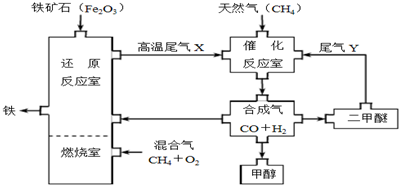
(1)在用合成气炼铁的流程中,向燃烧室通入甲烷与氧气的最佳体积配比V(CH4):V(O2)为1:2.
(2)尾气Y的成分与合成气的配比有关,则合成二甲醚时所发生的反应可能有2CO+4H2=CH3OCH3+H2O、3CO+3H2=CH3OCH3+CO2.
(3)在催化反应室中所发生的反应为可逆反应,则低压(填“高压”或“低压”)有利于合成气的合成.
(4)以Cu2O/ZnO为催化剂,由合成气合成甲醇可在一定温度和压强下自发进行,则反应:CO(g)+2H2(g)?CH3OH(g)在高温、低压条件下一定不能自发进行.为探究合成甲醇的适宜温度和压强,某同学设计了如下三组实验:
| 实验编号 | n(H 2)/n(CO) | T/℃ | P/MPa |
| i | m1 | 250 | 1 |
| ii | 3 | T1 | 5 |
| iii | m2 | 350 | P1 |
| A. | 同物质的量浓度的三种溶液的pH:a>b>c | |
| B. | 同pH时,三种溶液稀释相同倍数后,pH:a>b<c | |
| C. | 同pH、同体积的三种溶液消耗同浓度盐酸 的体积:a=b=c | |
| D. | 同pH时,稀释不同倍数、pH仍相同,三种溶液稀释的倍数:a>b>c |

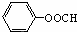 (写出结构简式).
(写出结构简式).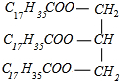 +3NaOH→C17H35COONa+
+3NaOH→C17H35COONa+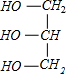 .
.