10.某烷烃的相对分子质量为72,与氯气发生取代反应所得的一氯代物只有一种的是( )
| A. | CH3CH3 | B. | 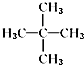 | C. |  | D. | 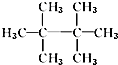 |
9.阿司匹林是人们熟知的感冒药,是第一个重要的人工合成药物,具有解热镇痛作用.其化学名为乙酰水杨酸,可由水杨酸与乙酸酐直接反应制得,二者的结构简式为: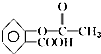 (阿司匹林)、
(阿司匹林)、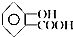 (水杨酸).下列有关二者所含官能团的说法正确的是( )
(水杨酸).下列有关二者所含官能团的说法正确的是( )
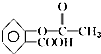 (阿司匹林)、
(阿司匹林)、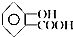 (水杨酸).下列有关二者所含官能团的说法正确的是( )
(水杨酸).下列有关二者所含官能团的说法正确的是( )| A. | 均含有碳碳双键 | B. | 均含酯基和羟基 | C. | 均为芳香化合物 | D. | 均含羧基和苯基 |
8.用石墨电极电解稀硫酸的过程中,溶液pH的变化情况为( )
| A. | 不改变 | B. | 逐渐减小 | C. | 逐渐增大 | D. | 先减小,后增大 |
7.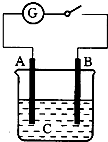 如图所示,把A、B插入C的溶液中,闭合电键后电流表的指针会发生偏转,且B上有气泡产生,则A、B、C可能是以下哪一组物质( )
如图所示,把A、B插入C的溶液中,闭合电键后电流表的指针会发生偏转,且B上有气泡产生,则A、B、C可能是以下哪一组物质( )
 如图所示,把A、B插入C的溶液中,闭合电键后电流表的指针会发生偏转,且B上有气泡产生,则A、B、C可能是以下哪一组物质( )
如图所示,把A、B插入C的溶液中,闭合电键后电流表的指针会发生偏转,且B上有气泡产生,则A、B、C可能是以下哪一组物质( )| A. | A-Cu B-Zn C-CuSO4 | B. | A-Ag B-Fe C-HCl | ||
| C. | A-Zn B-石墨 C-H2SO4 | D. | A-石墨 B-Zn C-H2SO4 |
6.已知 X、Y、Z、Q、R、E六种元素中,原子序数X<Y<Z<Q<R<E,其结构或性质信息如下表.
请根据信息回答有关问题:
(1)元素Y的原子核外共有7种不同运动状态的电子,有3种不同能级的电子;
(2)X、Y、Z三种元素的电负性由高到低的排列次序依次为(写元素符号)O>N>C;
(3)X、Z、Q元素均表现最低化合价时的三种氢化物中,沸点由高到低的排列次序依次为(写化学式)H2O>HCl>CH4;
(4)R的最高化合价为+6.R的一种配合物的化学式为RCl3•6H2O.已知0.01molRCl3•6H2O在水溶液中用过量硝酸银溶液处理,产生0.02molAgCl沉淀.此配合物最可能是B;
A.[R(H2O)6]Cl3 B.[R(H2O)5Cl]Cl2•H2O
C.[R(H2O)4Cl2]Cl•2H2O D.[R(H2O)3Cl3]•3H2O
(5)元素E能形成八面体构型的配合物离子[E(YH3)xQ2]+,则中心离子为(写化学式)Co3+,配位体为(写化学式)NH3和Cl-,x的值为4;
(6)Y的最低价氢化物与Z的一种氢化物反应,生成的两种产物均不污染环境,其反应的化学方程式为2NH3+3H2O2═N2+6H2O.
| 元素 | 结构或性质信息 |
| X | 原子的L层上s电子数等于p电子数. |
| Y | 原子核外的L层有3个未成对电子. |
| Z | 在元素周期表的各元素中电负性仅小于氟. |
| Q | 单质常温、常压下是气体,原子的M层上有1个未成对的p电子. |
| R | 核电荷数是Y与Q的核电荷数之和 |
| E | 原子序数比R大3 |
(1)元素Y的原子核外共有7种不同运动状态的电子,有3种不同能级的电子;
(2)X、Y、Z三种元素的电负性由高到低的排列次序依次为(写元素符号)O>N>C;
(3)X、Z、Q元素均表现最低化合价时的三种氢化物中,沸点由高到低的排列次序依次为(写化学式)H2O>HCl>CH4;
(4)R的最高化合价为+6.R的一种配合物的化学式为RCl3•6H2O.已知0.01molRCl3•6H2O在水溶液中用过量硝酸银溶液处理,产生0.02molAgCl沉淀.此配合物最可能是B;
A.[R(H2O)6]Cl3 B.[R(H2O)5Cl]Cl2•H2O
C.[R(H2O)4Cl2]Cl•2H2O D.[R(H2O)3Cl3]•3H2O
(5)元素E能形成八面体构型的配合物离子[E(YH3)xQ2]+,则中心离子为(写化学式)Co3+,配位体为(写化学式)NH3和Cl-,x的值为4;
(6)Y的最低价氢化物与Z的一种氢化物反应,生成的两种产物均不污染环境,其反应的化学方程式为2NH3+3H2O2═N2+6H2O.
5.在同温同压下,下列各组热化学方程式中△H1>△H2的是( )
| A. | 2H2(g)+O2(g)═2H2O(l);△H1 2H2(g)+O2(g)═2H2O(g);△H2 | |
| B. | 2S(g)+O2(g)═2SO2(g);△H1 2S(s)+O2(g)═2SO2(g);△H2 | |
| C. | C(s)+$\frac{1}{2}$O2(g)═CO(g);△H1C(s)+O2(g)═CO2(g);△H2 | |
| D. | H2(g)+Cl2(g)═2HCl(g);△H1 $\frac{1}{2}$H2(g)+$\frac{1}{2}$Cl2(g)═HCl(g);△H2 |
4.“类比推理”是一种重要的学习方法,但有时会产生错误的结论,下列类推结论中正确的是( )
| A. | 电解氯化镁制备镁,电解氯化铝也能制备铝 | |
| B. | ⅣA族元素氢化物沸点顺序是:GeH4>SiH4>CH4;则ⅤA族元素氢化物沸点顺序也是:AsH3>PH3>NH3 | |
| C. | 第二周期元素氢化物的稳定性顺序是:HF>H2O>NH3;则第三周期元素氢化物的稳定性顺序也是:HCl>H2S>PH3 | |
| D. | 干冰(CO2)是分子晶体,则SiO2也是分子晶体 |
2.A和B两元素能形成AB2 型离子化合物,则A和B的原子序数可能是( )
| A. | 6和8 | B. | 11和6 | C. | 20和8 | D. | 20和17 |
1.下列关于元素周期表和元素周期律的说法不正确的是( )
0 171629 171637 171643 171647 171653 171655 171659 171665 171667 171673 171679 171683 171685 171689 171695 171697 171703 171707 171709 171713 171715 171719 171721 171723 171724 171725 171727 171728 171729 171731 171733 171737 171739 171743 171745 171749 171755 171757 171763 171767 171769 171773 171779 171785 171787 171793 171797 171799 171805 171809 171815 171823 203614
| A. | 从氟到碘,其氢化物的稳定性逐渐减弱 | |
| B. | 因为铝原子比钠原子失去电子数目多,所以铝比钠的还原性强 | |
| C. | 第三周期从钠到氯,最高价氧化物的水化物碱性逐渐减弱,酸性逐渐增强 | |
| D. | 氧与硫为同主族元素,氧比硫的原子半径小,氧比硫的非金属性强 |
 ,B
,B ,C
,C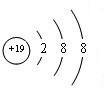 ,D
,D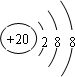 .它们离子的半径由大到小的顺序是r(S2-)>r(Cl-)>r(K+)>r(Ca2+).
.它们离子的半径由大到小的顺序是r(S2-)>r(Cl-)>r(K+)>r(Ca2+).