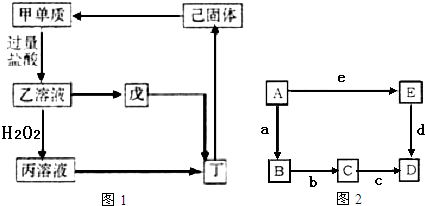
题目内容
8.用石墨电极电解稀硫酸的过程中,溶液pH的变化情况为( )| A. | 不改变 | B. | 逐渐减小 | C. | 逐渐增大 | D. | 先减小,后增大 |
分析 用石墨电极电解稀硫酸,阳极为氢氧根离子失电子发生氧化反应,阴极为氢离子得电子发生还原反应,据此分析.
解答 解:用石墨电极电解稀硫酸,阳极为氢氧根离子失电子发生氧化反应,阴极为氢离子得电子发生还原反应,其实质为电解水,所以电解过程中,硫酸硫酸浓度越来越大,则溶液pH的变化情况为逐渐减小,故选:B.
点评 本题考查学生电解池的工作原理,分析好阴阳两极的反应是解题关键,难度中等.

练习册系列答案
相关题目
18.将煤转化为水煤气的方法是通过化学高温方法将煤转化为洁净燃料的方法之一,煤转化为水煤气的主要反应为C+H2O$\frac{\underline{\;高温\;}}{\;}$CO+H2.有关物质的燃烧热数据如表所示:
已知:1mol H2O(g)转化为1mol H2O放出44.0kJ的热量.
①写出C完全燃烧的热化学方程式C(s)+O2(g)=CO2(g)△H=-393.5 kJ/mol;
②相同条件下,相同体积的氢气与一氧化碳完全燃烧,放出热量较多的是H2;
③写出煤转化为水煤气的主要反应的热化学方程式:C(s)+H2O(g)=CO(g)+H2(g)△H=+87.5kJ/mol.
| 物质 | C | H2 | CO |
| △H/kJ•mol-1 | -393.5 | -285.8 | -283.0 |
①写出C完全燃烧的热化学方程式C(s)+O2(g)=CO2(g)△H=-393.5 kJ/mol;
②相同条件下,相同体积的氢气与一氧化碳完全燃烧,放出热量较多的是H2;
③写出煤转化为水煤气的主要反应的热化学方程式:C(s)+H2O(g)=CO(g)+H2(g)△H=+87.5kJ/mol.
19.下列物质中属于含有极性键的非极性分子的是( )
| A. | CS2 | B. | H2O | C. | CH3CH2Cl | D. | NH3 |
16.一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示.下列描述不正确的是( )
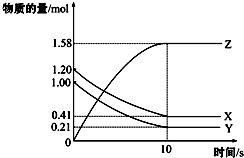

| A. | 反应开始到10s,用Z表示的反应速率为0.079mol/(L•s) | |
| B. | 该反应的方程式为:X(g)+Y(g)?2 Z(g) | |
| C. | 反应开始到10s时,Y的转化率为79.0% | |
| D. | 反应进行到10s时,该反应达到限度且各组分浓度相等 |
13.下列除杂质的方法不可行的是( )
| A. | 用过量氨水除去Al3+溶液中的少量Fe3+ | |
| B. | 将混合气体通过灼热的铜网除去N2中的少量O2 | |
| C. | 用新制的生石灰,通过加热蒸馏,以除去乙醇中的少量水 | |
| D. | 用饱和NaHCO3溶液除去混在H2中的HCl气体 |
17.下列实验操作能达到目的是( )
| A. | 用Na2S溶液和Al2(SO4)3溶液反应制取Al2S3固体 | |
| B. | 加热蒸发K2CO3溶液获得K2CO3晶体 | |
| C. | 加热蒸发FeCl2溶液制取Fe(OH)2固体 | |
| D. | 加热蒸发MgCl2溶液制取MgCl2固体 |
18.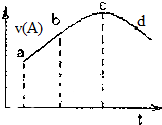 在恒温恒容的密闭容器中通入一定量的A、B,发生反应A(g)+2B(g)?3C(g)+D(l).如图是A的正反应速率v(A)随时间变化的示意图.下列说法正确的是( )
在恒温恒容的密闭容器中通入一定量的A、B,发生反应A(g)+2B(g)?3C(g)+D(l).如图是A的正反应速率v(A)随时间变化的示意图.下列说法正确的是( )
 在恒温恒容的密闭容器中通入一定量的A、B,发生反应A(g)+2B(g)?3C(g)+D(l).如图是A的正反应速率v(A)随时间变化的示意图.下列说法正确的是( )
在恒温恒容的密闭容器中通入一定量的A、B,发生反应A(g)+2B(g)?3C(g)+D(l).如图是A的正反应速率v(A)随时间变化的示意图.下列说法正确的是( )| A. | 反应物A的浓度:a点小于b点 | |
| B. | 可能是某种生物对反应起到的催化作用 | |
| C. | 曲线上的c、d两点都表示达到反应限度 | |
| D. | 平均反应速率:ab段大于bc段 |
 ,B
,B ,C
,C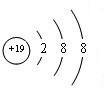 ,D
,D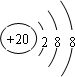 .它们离子的半径由大到小的顺序是r(S2-)>r(Cl-)>r(K+)>r(Ca2+).
.它们离子的半径由大到小的顺序是r(S2-)>r(Cl-)>r(K+)>r(Ca2+).