题目内容
9.阿司匹林是人们熟知的感冒药,是第一个重要的人工合成药物,具有解热镇痛作用.其化学名为乙酰水杨酸,可由水杨酸与乙酸酐直接反应制得,二者的结构简式为: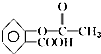 (阿司匹林)、
(阿司匹林)、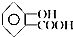 (水杨酸).下列有关二者所含官能团的说法正确的是( )
(水杨酸).下列有关二者所含官能团的说法正确的是( )| A. | 均含有碳碳双键 | B. | 均含酯基和羟基 | C. | 均为芳香化合物 | D. | 均含羧基和苯基 |
分析 根据常见的官能团有:碳碳双键、碳碳三键、-OH、-X、-CHO、-COOH、-COOR来分析.
解答 解:A、由于苯环不是单双键交替的结构,根据两者的结构可知,两者中均不含碳碳双键,故A错误;
B、根据两者的结构可知,阿司匹林中含酯基,但水杨酸中不含酯基;阿司匹林中不含羟基,但水杨酸中含羟基,故B错误;
C、含苯环的化合物为芳香化合物,两者中均含苯环,故均为芳香化合物,故C正确;
D、两者中均含苯基和羧基,故D正确.
故选CD.
点评 本题考查了有机物的结构以及含有的官能团,应注意的是苯环不是单双键交替的结构,即苯环中无碳碳双键.

练习册系列答案
相关题目
19.下列有关物质结构的说法正确的是( )
| A. | PCl3和H2O分子中所有原子的最外层都达到8电子稳定结构 | |
| B. | HBr的电子式为 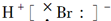 | |
| C. | 3.4 g氨气中含有0.6NA个N-H键 | |
| D. | 78 g Na2O2晶体中所含阴、阳离子个数均为4NA |
20.高氯酸铵为“神舟八号”提供轨道舱气体,高氯酸铵是一种火箭燃烧的重要载氧体,化学式为NH4ClO4,下列有关叙述不正确的是( )
| A. | 高氯酸铵为离子化合物 | |
| B. | 高氯酸铵中只含有离子键 | |
| C. | 高氯酸铵中既有离子键又有共价键,同时还有配位键 | |
| D. | 高氯酸铵中阴、阳离子的个数比为1:1 |
17.X、Y、Z、W为四种短周期元素,它们的性质、原子结构等信息如表:
回答下列问题:
(1)W在元素周期表中的位置是第三周期第ⅦA 族.X、Y、W三种元素的简单离子半径大小是S2->Cl->Na+;(用离子符号表示)
(2)Y单质在氧气中燃烧的产物的电子式为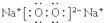 .用电子式表示元素X与Y形成化合物的过程
.用电子式表示元素X与Y形成化合物的过程 ;
;
(3)Z的气态氢化物的沸点反常,原因是NH3分子间存在氢键.元素W与元素X相比,非金属性较强的是Cl(用元素符号表示),下列表述中能证明这一事实的是②④;
①常温下W的单质和X的单质状态不同
②W的氢化物比X的氢化物稳定
③一定条件下W和X的单质都能与氢氧化钠溶液反应
④W的单质可以和X的氢化物水溶液反应置换出X
(4)Z2在一定条件下能和氢气反应生成气态氢化物,已知破坏1mol氢气中的化学键消耗的能量为Q1kJ,破坏1molZ2中的化学键消耗的能量为Q2kJ,形成1molZ-H化学键释放的能量为O3kJ,则上述反应放出的能量可表示为6Q3-3Q1-Q2kJ.
| X | 原子M层上的电子数是原子核外电子层数的2倍 |
| Y | 短周期中原子半径最大的元素 |
| Z | 元素的单质为双原子分子,Z的氢化物水溶液呈碱性 |
| W | 元素最高正价是+7价 |
(1)W在元素周期表中的位置是第三周期第ⅦA 族.X、Y、W三种元素的简单离子半径大小是S2->Cl->Na+;(用离子符号表示)
(2)Y单质在氧气中燃烧的产物的电子式为
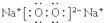 .用电子式表示元素X与Y形成化合物的过程
.用电子式表示元素X与Y形成化合物的过程 ;
;(3)Z的气态氢化物的沸点反常,原因是NH3分子间存在氢键.元素W与元素X相比,非金属性较强的是Cl(用元素符号表示),下列表述中能证明这一事实的是②④;
①常温下W的单质和X的单质状态不同
②W的氢化物比X的氢化物稳定
③一定条件下W和X的单质都能与氢氧化钠溶液反应
④W的单质可以和X的氢化物水溶液反应置换出X
(4)Z2在一定条件下能和氢气反应生成气态氢化物,已知破坏1mol氢气中的化学键消耗的能量为Q1kJ,破坏1molZ2中的化学键消耗的能量为Q2kJ,形成1molZ-H化学键释放的能量为O3kJ,则上述反应放出的能量可表示为6Q3-3Q1-Q2kJ.
4.“类比推理”是一种重要的学习方法,但有时会产生错误的结论,下列类推结论中正确的是( )
| A. | 电解氯化镁制备镁,电解氯化铝也能制备铝 | |
| B. | ⅣA族元素氢化物沸点顺序是:GeH4>SiH4>CH4;则ⅤA族元素氢化物沸点顺序也是:AsH3>PH3>NH3 | |
| C. | 第二周期元素氢化物的稳定性顺序是:HF>H2O>NH3;则第三周期元素氢化物的稳定性顺序也是:HCl>H2S>PH3 | |
| D. | 干冰(CO2)是分子晶体,则SiO2也是分子晶体 |
14.将ag水煤气(成分为CO和H2)充分燃烧,将燃烧生成的气体(150℃)通过盛有过量的Na2O2的干燥管(反应气体无损失),充分反应后干燥管增重bg,则a和b的关系为( )
| A. | a=b | B. | a>b | C. | a<b | D. | 无法比较 |
18.下列叙述正确的是( )
| A. | 室温下pH=7的CH3COOH与CH3COONa的混合液中离子的浓度大小顺序为:c(Na+)>c(CHCOO-)>c(H+)=c(OH-) | |
| B. | 0.1mol/LKHS的溶液中,c(K+)═2c(S2-)+c(HS-)+c(H2S) | |
| C. | 25℃时,pH均为12的NaOH溶液和Na2CO3溶液中由水电离出的c(OH-),前者小于后者 | |
| D. | 中和pH和体积相同的盐酸与醋酸溶液,消耗NaOH的物质的量相等 |
19.下列说法正确的是( )
| A. | 铅笔芯的原材料为铅,儿童使用铅笔时如果用嘴吮咬能够引起铅中毒 | |
| B. | 酸雨形成的主要原因是汽车尾气的任意排放 | |
| C. | 维生素C受热更易被氧化,故有些新鲜蔬菜生吃较好 | |
| D. | 淀粉、纤维素,、蛋白质和油脂均属于天然高分子化合物 |