1.中国-094核潜艇上的核反应堆内使用了液体钠铝合金(单质钠和单质铝熔合而成,可看作二者的混合物)做载热介质,有关说法不正确的是( )
| A. | 铝钠合金投入到足量氯化铜溶液中,肯定有氢氧化铜沉淀也可能有铜析出 | |
| B. | 铝钠合金若投入一定的水中可得无色溶液,则n(Al)≤n(Na) | |
| C. | mg钠铝合金投入足量水中,若所得溶液只含一种溶质,则其中含有钠的质量为0.46mg | |
| D. | 若mg不同组成的铝钠合金投入足量盐酸中,若放出的H2越多,则钠的质量分数越大 |
20.在离子浓度都为0.1mol/L下列溶液中,加入(或通入)某物质后,发生反应先后顺序正确是( )
| A. | 在含Fe3+、Cu2+、H+的溶液中加入锌粉:Cu 2+、Fe3+、H+ | |
| B. | 在含I-、SO32-、Br-的溶液中不断通入氯气:I-、Br-、SO32- | |
| C. | 在含AlO2-、SO32-、OH-的溶液中逐滴加入硫酸氢钠溶液:OH-、AlO2-、SO32- | |
| D. | 在含Fe 3+、H+、NH4+ 的溶液中逐渐加入烧碱溶液:Fe3+、NH4+、H+ |
19.在一定量的偏铝酸钠溶液中,加入下列哪一种溶液可使获得的沉淀量最大( )
| A. | 硫酸铝 | B. | 盐酸 | C. | 二氧化碳 | D. | 硫酸 |
17.酸性锌锰干电池是一种一次电池,外壳为金属锌,中间是碳棒,其周围是有碳粉,二氧化锰,氯化锌和氯化铵等组成的填充物,该电池在放电过程产生MnOOH,回收处理该废电池可以得到多种化工原料,有关数据表所示:
溶解度/(g/100g水)
回答下列问题:
(1)该电池的负极为锌,正极反应式为MnO2+H++e-=MnOOH;
(2)维持电流强度为0.5A,电池工作5分钟,理论消耗Zn0.05gg;(已知F=96500C/mol)
(3)废电池糊状填充物加水处理后,过滤,滤液中主要有氯化锌和氯化铵,两者可以通过加热浓缩、冷却结晶分离回收,滤渣的主要成分是二氧化锰、碳粉和MnOOH,欲从中得到较纯的二氧化锰,最简便的方法是空气中加热,其原理是碳粉转变为二氧化碳,MnOOH氧化为二氧化锰;
(4)用废电池的锌皮制作七水合硫酸锌,需去除少量杂质铁,其方法是:加入稀硫酸和双氧水,溶解,铁变为Fe3+加碱调节PH为2.7,铁刚好完全沉淀(离子浓度≤1×10-5 mo1•L-1时即可认为离子沉淀完全)继续加碱调节PH为6锌开始沉淀(假定此时溶液中Zn2+的浓度为0.1mo1•L-1).若上述过程不加双氧水的后果Zn2+和Fe2+分离不开,原因是Fe(OH)2和Zn(OH)2的Ksp相近.
溶解度/(g/100g水)
温度/℃ 化合物 | 0 | 20 | 40 | 60 | 80 | 100 |
| NH4Cl | 29.3 | 37.2 | 45.8 | 55.3 | 65.6 | 77.3 |
| ZnCl2 | 343 | 395 | 452 | 488 | 541 | 614 |
| 化合物 | Zn(OH)2 | Fe(OH)2 | Fe(OH)3 |
| Ksp近似值 | 10-17 | 10-17 | 10-39 |
(1)该电池的负极为锌,正极反应式为MnO2+H++e-=MnOOH;
(2)维持电流强度为0.5A,电池工作5分钟,理论消耗Zn0.05gg;(已知F=96500C/mol)
(3)废电池糊状填充物加水处理后,过滤,滤液中主要有氯化锌和氯化铵,两者可以通过加热浓缩、冷却结晶分离回收,滤渣的主要成分是二氧化锰、碳粉和MnOOH,欲从中得到较纯的二氧化锰,最简便的方法是空气中加热,其原理是碳粉转变为二氧化碳,MnOOH氧化为二氧化锰;
(4)用废电池的锌皮制作七水合硫酸锌,需去除少量杂质铁,其方法是:加入稀硫酸和双氧水,溶解,铁变为Fe3+加碱调节PH为2.7,铁刚好完全沉淀(离子浓度≤1×10-5 mo1•L-1时即可认为离子沉淀完全)继续加碱调节PH为6锌开始沉淀(假定此时溶液中Zn2+的浓度为0.1mo1•L-1).若上述过程不加双氧水的后果Zn2+和Fe2+分离不开,原因是Fe(OH)2和Zn(OH)2的Ksp相近.
16.NA为阿伏伽德罗常数的值,下列叙述正确的是( )
0 171420 171428 171434 171438 171444 171446 171450 171456 171458 171464 171470 171474 171476 171480 171486 171488 171494 171498 171500 171504 171506 171510 171512 171514 171515 171516 171518 171519 171520 171522 171524 171528 171530 171534 171536 171540 171546 171548 171554 171558 171560 171564 171570 171576 171578 171584 171588 171590 171596 171600 171606 171614 203614
| A. | 1.0L1.0mo1•L-1的NaAlO2水溶液中含有的氧原子数为2NA | |
| B. | 28g乙烯和丙烯的混合物含有的碳原子数为为2NA | |
| C. | 25℃时pH=13的NaOH溶液中含有OH一的数目为0.1NA | |
| D. | 1mol的羟基与1 mol的氢氧根离子所含电子数均为9NA |
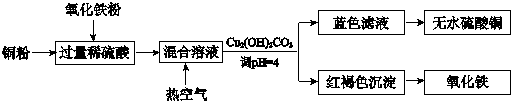
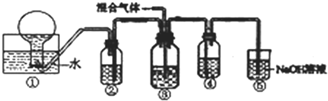 H、C、N、O、Mg、Al、Si、S、Cu是中学化学中常见的元素,请根据题意回答与这些元素有关的问题:
H、C、N、O、Mg、Al、Si、S、Cu是中学化学中常见的元素,请根据题意回答与这些元素有关的问题: ;
;