题目内容
2.硫酸是用途广泛的化工原料,可作脱水剂、吸水剂、氧化剂和催化剂等.工业制硫酸铜的方法很多.(1)方法一、用浓硫酸和铜制取硫酸铜.该反应的化学方程式是Cu+2H2SO4(浓)$\frac{\underline{\;加热\;}}{\;}$CuSO4+SO2↑+2H2O,此法的最大缺点是产生有污染的气体;
(2)方法二、用稀硫酸、铜和氧化铁制取硫酸铜,生产的主要过程如图所示:
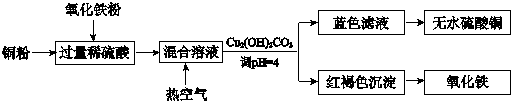
稀硫酸、铜和氧化铁反应的离子方程式是Fe2O3+6H+═2Fe3++3H2O、2Fe3++Cu═2Fe2++Cu2+;向混合溶液中通入热空气的反应的离子方程式是4Fe2++4H++O2═4Fe3++2H2O;由滤液得到无水硫酸铜的实验操作是加热、蒸发.
分析 (1)浓硫酸与铜反应生成硫酸铜、二氧化硫和水,结合二氧化硫的毒性解答;
(2)由流程图可知:稀硫酸、铜和氧化铁反应是氧化铁和稀硫酸反应生成硫酸铁和水,硫酸铁和铜反应生成氯化亚铁和氯化铜;通入热的空气是为了氧化亚铁离子为三价铁离子,调整溶液PH除去铁离子;溶液中得到溶质固体的方法是蒸发水结晶析出;
解答 解:(1)浓硫酸与铜反应生成硫酸铜、二氧化硫和水,化学方程式:Cu+2H2SO4(浓)$\frac{\underline{\;加热\;}}{\;}$CuSO4+SO2↑+2H2O;反应生成的二氧化硫是污染环境的气体,产生了有污染的气体;故答案为:Cu+2H2SO4(浓)$\frac{\underline{\;加热\;}}{\;}$CuSO4+SO2↑+2H2O;产生了有污染的气体;
(2)由流程图可知:稀硫酸、铜和氧化铁反应是氧化铁和稀硫酸反应生成硫酸铁和水,硫酸铁和铜反应生成氯化亚铁和氯化铜,反应的离子方程式为:Fe2O3+6H+═2Fe3++3H2O、2Fe3++Cu═2Fe2++Cu2+;通入空气的作用是氧气氧化亚铁离子为铁离子的反应,反应离子方程式为:4Fe2++4H++O2═4Fe3++2H2O;得到硫酸铜溶液加热蒸发得到硫酸铜晶体;加热、蒸发;
故答案为:Fe2O3+6H+═2Fe3++3H2O、2Fe3++Cu═2Fe2++Cu2+;4Fe2++4H++O2═4Fe3++2H2O;加热、蒸发;
点评 本题考查了硫酸铜的制备,明确浓硫酸、铁及其化合物铜及其化合物性质,明确工艺流程图即可解答,题目难度不大.

练习册系列答案
相关题目
12.氢氧燃料电池是一种新能源.图为氢氧燃料电池示意图.下列说法不正确的是( )
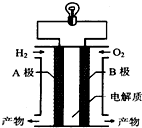

| A. | 电子由B极通过导线流向A极 | |
| B. | A极是负极,B极是正极 | |
| C. | 该装置能将化学能转化为电能 | |
| D. | 产物为无污染的水,属于环境友好电池 |
10.根据理论研究,元素周期表可容纳164种元素.理论上164号、114号、14号元素位于同一主族.根据你所学知识,下列有关预测肯定不正确的是( )
| A. | 164号元素是金属元素 | |
| B. | 164号元素位于ⅣA族 | |
| C. | 164号元素对应的最高价氧化物的水化物其碱性比114号的强 | |
| D. | 164号元素存在稳定的气态氢化物,且还原性比SiH4弱 |
17.酸性锌锰干电池是一种一次电池,外壳为金属锌,中间是碳棒,其周围是有碳粉,二氧化锰,氯化锌和氯化铵等组成的填充物,该电池在放电过程产生MnOOH,回收处理该废电池可以得到多种化工原料,有关数据表所示:
溶解度/(g/100g水)
回答下列问题:
(1)该电池的负极为锌,正极反应式为MnO2+H++e-=MnOOH;
(2)维持电流强度为0.5A,电池工作5分钟,理论消耗Zn0.05gg;(已知F=96500C/mol)
(3)废电池糊状填充物加水处理后,过滤,滤液中主要有氯化锌和氯化铵,两者可以通过加热浓缩、冷却结晶分离回收,滤渣的主要成分是二氧化锰、碳粉和MnOOH,欲从中得到较纯的二氧化锰,最简便的方法是空气中加热,其原理是碳粉转变为二氧化碳,MnOOH氧化为二氧化锰;
(4)用废电池的锌皮制作七水合硫酸锌,需去除少量杂质铁,其方法是:加入稀硫酸和双氧水,溶解,铁变为Fe3+加碱调节PH为2.7,铁刚好完全沉淀(离子浓度≤1×10-5 mo1•L-1时即可认为离子沉淀完全)继续加碱调节PH为6锌开始沉淀(假定此时溶液中Zn2+的浓度为0.1mo1•L-1).若上述过程不加双氧水的后果Zn2+和Fe2+分离不开,原因是Fe(OH)2和Zn(OH)2的Ksp相近.
溶解度/(g/100g水)
温度/℃ 化合物 | 0 | 20 | 40 | 60 | 80 | 100 |
| NH4Cl | 29.3 | 37.2 | 45.8 | 55.3 | 65.6 | 77.3 |
| ZnCl2 | 343 | 395 | 452 | 488 | 541 | 614 |
| 化合物 | Zn(OH)2 | Fe(OH)2 | Fe(OH)3 |
| Ksp近似值 | 10-17 | 10-17 | 10-39 |
(1)该电池的负极为锌,正极反应式为MnO2+H++e-=MnOOH;
(2)维持电流强度为0.5A,电池工作5分钟,理论消耗Zn0.05gg;(已知F=96500C/mol)
(3)废电池糊状填充物加水处理后,过滤,滤液中主要有氯化锌和氯化铵,两者可以通过加热浓缩、冷却结晶分离回收,滤渣的主要成分是二氧化锰、碳粉和MnOOH,欲从中得到较纯的二氧化锰,最简便的方法是空气中加热,其原理是碳粉转变为二氧化碳,MnOOH氧化为二氧化锰;
(4)用废电池的锌皮制作七水合硫酸锌,需去除少量杂质铁,其方法是:加入稀硫酸和双氧水,溶解,铁变为Fe3+加碱调节PH为2.7,铁刚好完全沉淀(离子浓度≤1×10-5 mo1•L-1时即可认为离子沉淀完全)继续加碱调节PH为6锌开始沉淀(假定此时溶液中Zn2+的浓度为0.1mo1•L-1).若上述过程不加双氧水的后果Zn2+和Fe2+分离不开,原因是Fe(OH)2和Zn(OH)2的Ksp相近.
7.装置图所示,有关分析不正确的是( )
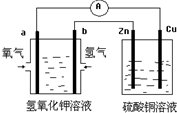

| A. | 该装置中Cu极为阳极 | |
| B. | 工作时,左池中K+移向a电极 | |
| C. | 工作一段时间,要使右池溶液复原可加入适量的CuO | |
| D. | b极的电极反应式:H2+2OH--2e-═2H2O |
14.设NA 为阿伏伽德罗常数的值,下列叙述正确的是( )
| A. | 1mol羟基中电子数为10NA | |
| B. | 常温下,1L 0.1mol/L的NH4NO3的溶液中氮原子数为0.2NA | |
| C. | 在反应KIO3+6HI=KI+3 I2+3 H2O中,每生成3mol I2转移的电子数为6NA | |
| D. | 常温常压下,22.4L乙烯中C-H键数为4NA |
 如图是一种形状酷似一条小狗的有机物.化学家Tim Rickard将其取名为“doggycene”.doggycene的分子式为C26H26.该分子中所有碳原子可能(填“可能”或“不可能”)处予同一平面.
如图是一种形状酷似一条小狗的有机物.化学家Tim Rickard将其取名为“doggycene”.doggycene的分子式为C26H26.该分子中所有碳原子可能(填“可能”或“不可能”)处予同一平面.
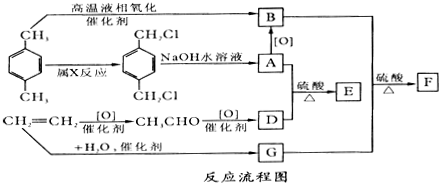
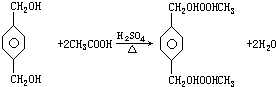 ;B+G→F
;B+G→F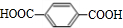 +CH3CH2OH$→_{△}^{浓H_{2}SO_{4}}$
+CH3CH2OH$→_{△}^{浓H_{2}SO_{4}}$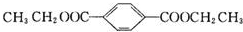 .
.