题目内容
20.在离子浓度都为0.1mol/L下列溶液中,加入(或通入)某物质后,发生反应先后顺序正确是( )| A. | 在含Fe3+、Cu2+、H+的溶液中加入锌粉:Cu 2+、Fe3+、H+ | |
| B. | 在含I-、SO32-、Br-的溶液中不断通入氯气:I-、Br-、SO32- | |
| C. | 在含AlO2-、SO32-、OH-的溶液中逐滴加入硫酸氢钠溶液:OH-、AlO2-、SO32- | |
| D. | 在含Fe 3+、H+、NH4+ 的溶液中逐渐加入烧碱溶液:Fe3+、NH4+、H+ |
分析 A.铁离子氧化性最大,则加入锌后铁离子优先反应;
B.还原性越强的离子优先被氯气氧化;
C.氢氧根离子结合氢离子能力最强,其次是偏铝酸根离子,最弱的为亚硫酸根离子;
D.根据结合氢氧根离子能力H+>Fe3+>NH4+进行判断.
解答 解:A.在含Fe3+、Cu2+、H+的溶液中加入锌粉,由于氧化性:Fe3+>Cu2+>H+,则发生反应的先后顺序为:Fe3+、Cu2+、H+,故A错误;
B.在含I-、SO32-、Br-的溶液中不断通入氯气,由于还原性大小为:Br-<I-<SO32-,则发生反应的先后顺序为:SO32-、I-、Br-故B错误;
C.在含AlO2-、SO32-、OH-的溶液中逐滴加入硫酸氢钠溶液,结合氢离子能力大小为:OH->AlO2->SO32-,故C正确;
D.含Fe3+、H+、NH4+的溶液中逐渐加入烧碱溶液,结合氢氧根离子能力大小为:H+>Fe3+>NH4+,故D错误;
故选C.
点评 本题考查了常见离子的性质、氧化还原反应的综合应用等知识,题目难度中等,明确常见离子的性质为解答根据,注意掌握氧化还原反应中氧化性、还原性强弱的判断方法.

练习册系列答案
相关题目
8.把0.02mol/LCH3COOH溶液和0.01mol/LNaOH溶液以等体积混和,则混合液中微粒浓度关系正确的为( )
| A. | c(CH3COO-)<c(Na+) | B. | c(OH-)>c(H+) | ||
| C. | c(CH3COOH)>c(CH3COO-) | D. | c(CH3COOH)+c (CH3COO-)=0.02mol/L |
15.下列说法正确的是( )
| A. | 用活性炭去除冰箱中的异味是发生了化学反应 | |
| B. | 用热碱水清除炊具上残留的油污,是因为Na2CO3可直接和油污反应 | |
| C. | 用浸泡过高锰酸钾溶液的硅藻土保存水果 | |
| D. | 漂白粉在空气中久置变质是因为漂白粉中的CaCl2 与空气中的CO2反应生成CaCO3 |
12.某饱和一元醇 8g 与足量金属钠反应产生氢气 2.8L(标准状况).该醇可能是( )
| A. | 甲醇 | B. | 乙醇 | C. | 丙醇 | D. | 丁醇 |
1.下列各组有机物中,无论以何种比例混合,只要二者物质的量之和不变,完全燃烧时消耗O2的物质的量和生成H2O的物质的量保持不变的是( )
| A. | 乙烯、丙烯酸(CH2=CH-COOH) | B. | 乙酸、甲醛(HCHO) | ||
| C. | 甲烷、乙二醇(HOCH2CH2OH) | D. | 乙烷、乙醇 |

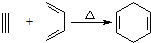 ,请回答下列问题.
,请回答下列问题. ,所用的原料可以是AD
,所用的原料可以是AD .
. H、C、N、O、Mg、Al、Si、S、Cu是中学化学中常见的元素,请根据题意回答与这些元素有关的问题:
H、C、N、O、Mg、Al、Si、S、Cu是中学化学中常见的元素,请根据题意回答与这些元素有关的问题: ;
;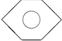 )、④甲苯(
)、④甲苯(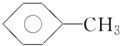 ),
), .此反应属于取代反应.
.此反应属于取代反应.