题目内容
19.在一定量的偏铝酸钠溶液中,加入下列哪一种溶液可使获得的沉淀量最大( )| A. | 硫酸铝 | B. | 盐酸 | C. | 二氧化碳 | D. | 硫酸 |
分析 A.加入Al2(SO4)3发生反应:6NaAlO2+Al2(SO4)3+12H2O=8Al(OH)3↓+3Na2SO4,1mol偏铝酸钠最多生成Al(OH)3沉淀$\frac{4}{3}$mol;
B.加入HCl发生反应:NaAlO2+HCl+H2O=Al(OH)3↓+NaCl、Al(OH)3+3HCl=AlCl3+3H2O,1mol偏铝酸钠生成Al(OH)3沉淀0~1mol,最多生成Al(OH)3沉淀1mol;
C.通入CO2发生反应:NaAlO2+CO2(少量)+3H2O=Al(OH)3↓+Na2CO3或NaAlO2+CO2(足量)+2H2O=Al(OH)3↓+NaHCO3,1mol偏铝酸钠最多生成1molAl(OH)3沉淀;
D.加入H2SO4发生反应:2NaAlO2+H2SO4+2H2O=2Al(OH)3↓+Na2SO4,2Al(OH)3+3H2SO4=Al2(SO4)3+6H2O,1mol偏铝酸钠生成Al(OH)3沉淀0~1mol,最多生成1molAl(OH)3沉淀.
解答 解:A.在一定量的偏铝酸钠溶液中加入Al2(SO4)3,发生生反应:6NaAlO2+Al2(SO4)3+12H2O=8Al(OH)3↓+3Na2SO4,1mol偏铝酸钠最多生成Al(OH)3沉淀$\frac{4}{3}$mol;
B.在一定量的偏铝酸钠溶液中加入HCl,发生反应:NaAlO2+HCl+H2O=Al(OH)3↓+NaCl,Al(OH)3+3HCl=AlCl3+3H2O,1mol偏铝酸钠生成Al(OH)3沉淀0~1mol,最多生成Al(OH)3沉淀1mol;
C.在一定量的偏铝酸钠溶液中通入CO2,发生反应:NaAlO2+CO2(少量)+3H2O=Al(OH)3↓+Na2CO3或NaAlO2+CO2(足量)+2H2O=Al(OH)3↓+NaHCO3,1mol偏铝酸钠最多生成Al(OH)3沉淀1mol;
D.在一定量的偏铝酸钠溶液中加入H2SO4,发生反应:2NaAlO2+H2SO4+2H2O=2Al(OH)3↓+Na2SO4,2Al(OH)3+3H2SO4=Al2(SO4)3+6H2O,1mol偏铝酸钠生成Al(OH)3沉淀0~1mol,最多生成Al(OH)3沉淀1mol;
根据以上分析可知,在一定量的偏铝酸钠溶液中,加入Al2(SO4)3获得的沉淀量最大,
故选A.
点评 本题考查偏铝酸钠的性质,题目难度不大,明确铝及其化合物的性质为解答关键,注意掌握铝离子与偏铝酸根离子发生双水解反应情况,试题培养了学生的分析能力及灵活应用能力.

 断开1mol AB(g)分子中的化学键使其分别生成气态A原子和气态B原子所吸收的能量称为A-B键的键能.下表列出了一些化学键的键能E:
断开1mol AB(g)分子中的化学键使其分别生成气态A原子和气态B原子所吸收的能量称为A-B键的键能.下表列出了一些化学键的键能E:| 化学键 | H-H | Cl-Cl | O═O | C-Cl | C-H | O-H | H-Cl |
| E/kJ•mol-1 | 436 | 247 | x | 330 | 413 | 463 | 431 |
(1)如图表示某反应的能量变化关系,则此反应为放热(填“吸热”或“放热”)反应,其中△H=(a-b) kJ•mol-1(用含有a、b的关系式表示).
(2)若图示中表示反应H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=-241.8kJ•mol-1,则b=926kJ•mol-1,O═O 键的键能x=496.4.
| A. | 铝溶于烧碱溶液的离子方程式:Al+2OH-═AlO2-+H2↑ | |
| B. | 锌铜原电池正极反应式:Cu-2e-═Cu2+ | |
| C. | 次氯酸的电离方程式:HClO?H++ClO- | |
| D. | 已知中和热为57.3 kJ•mol-1,稀硫酸与氢氧化钠稀溶液反应的热化学方程式为:H2SO4 (aq)+2NaOH (aq)═Na2SO4 (aq)+2H2O ( l )△H=-57.3 kJ•mol-1 |
| A. | HOCH2CH2OH | B. | HOCH2CH(OH)CH3 | C. | HOCH2CH2CH2OH | D. | CH3CH(OH)CH(OH)CH3 |
| A. | 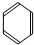 | B. | 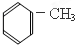 | C. | 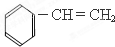 | D. | 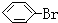 |
| A. | 仅用溴水一种试剂可将苯、己烯、乙醇、四氯化碳、亚硫酸钠溶液五种物质鉴别开来 | |
| B. | Na2O2中既含离子键又含共价键,其所含的阳离子对阴离子的个数比为2:1 | |
| C. | 甲烷、新戊烷与2,2,3,3-四甲基丁烷的一氯代物均只有一种 | |
| D. | 硬脂酸(C17H35COOH)与乙酸、甲醇与乙二醇(HOCH2CH2OH)均互为同系物关系 |