8.短周期元素在周期表中的位置关系如图所示.
(1)X元素的单质的分子式是He,若X核内中子数与质子数相等,则X的摩尔质量为4g/mol.
(2)Y与氢化合形成的化合物的结构式为H-F,在同主族元素的氢化物分子中,该氢化物分子中共价键键能最大,原因是同主族中F原子半径最小,故H-F键长最短,H-F键最稳定,H-F键能最大.
(3)Z单质的晶体属于分子晶体,Z的氢化物的电子式是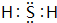 ,该分子中含2个σ键,0个π键(若不含填0).
,该分子中含2个σ键,0个π键(若不含填0).
| X | ||
| Y | ||
| Z |
(2)Y与氢化合形成的化合物的结构式为H-F,在同主族元素的氢化物分子中,该氢化物分子中共价键键能最大,原因是同主族中F原子半径最小,故H-F键长最短,H-F键最稳定,H-F键能最大.
(3)Z单质的晶体属于分子晶体,Z的氢化物的电子式是
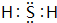 ,该分子中含2个σ键,0个π键(若不含填0).
,该分子中含2个σ键,0个π键(若不含填0).
7.已知短周期元素的离子aW3+、bX+、cY2-、dZ-都具有相同的电子层结构,下列关系正确的是( )
| A. | 质子数c>b | B. | 离子的还原性Z->Y2- | ||
| C. | 氢化物的稳定性H2Y>HZ | D. | 原子半径X>W |
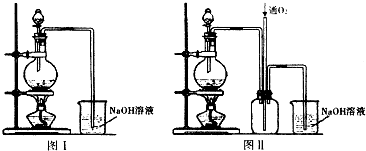
6.半导体生产的外延生长工序中,常需要控制掺杂,以保证控制电阻率,其中三氯化磷(PCl3)是一种重要的掺杂剂.实验室要用黄磷与干燥的Cl2模拟工业生产制取PCl3,用图1装置制取Cl2,图2装置制取PCl3,部分仪器已省略.已知黄磷与少量Cl2反应生成PCl3.与过量Cl2反应生成PCl5、PCl3遇O2会生成POCl3、POCl3溶于PCl3,PCl3遇水会强烈水解生成H3PO3和HCl.

请根据以上信息,回答下列问题:
(1)仪器乙的名称蒸馏烧瓶;
(2)冷凝管中的冷却水从a口进(填“a”或“b”);
(3)写出实验室制氯气的离子方程式MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O;
(4)向仪器甲中通入干燥Cl2之前,应先通入一会干燥CO2,其目的是排尽甲装置中的空气,防止生成的PCl3与空气中的O2和H2O反应;
(5)碱石灰的作用是吸收多余氯气防止污染空气,防止空气中的水蒸气进入烧瓶中与PCl3反应;
(6)已知PCl5遇水发生强烈水解生成两种酸,写出PCl5与水反应的化学方程式PCl5+4H2O═5HCl+H3PO4;
(7)粗产品中常含有POCl3、PCl5等.加入黄磷加热除去PCl5后,通过蒸馏(填实验操作名称),即可得到纯净的PCl3;
(8)测定产品中PCl3的质量分数:迅速称取ag产品,加水反应后配成250mL溶液,取出25.00mL加入过量的c1mol•L-1V1mL碘溶液,充分反应后再用c2mol•L-1Na2S2O3溶液滴定过量的碘,终点时消耗V2mLNa2S2O3溶液.已知:H3PO3+H2O+I2=H3PO4+2H1:I2+2Na2S2O3=2Na1+Na2S4O6;假设测定过程中没有其他反应.根据上述数据:该产品中PC13的质量分数为$\frac{({c}_{1}{V}_{1}-\frac{1}{2}{C}_{2}{V}_{2})×1{0}^{-3}×137.5×10}{a}$×100%(用含字母的代数式表示).

| 物质 | 熔点/℃ | 沸点/℃ |
| PCl3 | -112 | 75.5 |
| POCl3 | 2 | 105.3 |
(1)仪器乙的名称蒸馏烧瓶;
(2)冷凝管中的冷却水从a口进(填“a”或“b”);
(3)写出实验室制氯气的离子方程式MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O;
(4)向仪器甲中通入干燥Cl2之前,应先通入一会干燥CO2,其目的是排尽甲装置中的空气,防止生成的PCl3与空气中的O2和H2O反应;
(5)碱石灰的作用是吸收多余氯气防止污染空气,防止空气中的水蒸气进入烧瓶中与PCl3反应;
(6)已知PCl5遇水发生强烈水解生成两种酸,写出PCl5与水反应的化学方程式PCl5+4H2O═5HCl+H3PO4;
(7)粗产品中常含有POCl3、PCl5等.加入黄磷加热除去PCl5后,通过蒸馏(填实验操作名称),即可得到纯净的PCl3;
(8)测定产品中PCl3的质量分数:迅速称取ag产品,加水反应后配成250mL溶液,取出25.00mL加入过量的c1mol•L-1V1mL碘溶液,充分反应后再用c2mol•L-1Na2S2O3溶液滴定过量的碘,终点时消耗V2mLNa2S2O3溶液.已知:H3PO3+H2O+I2=H3PO4+2H1:I2+2Na2S2O3=2Na1+Na2S4O6;假设测定过程中没有其他反应.根据上述数据:该产品中PC13的质量分数为$\frac{({c}_{1}{V}_{1}-\frac{1}{2}{C}_{2}{V}_{2})×1{0}^{-3}×137.5×10}{a}$×100%(用含字母的代数式表示).
5.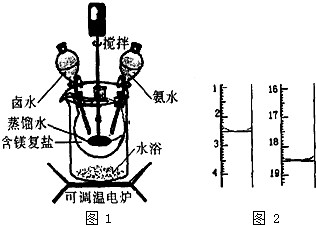 碱式碳酸镁密度小,是橡胶制品的优良填料.可用复盐MgCO3•(NH4)2CO3•H2O作原料制各.取一定量的含镁复盐放三颈烧瓶中,并将三颈烧瓶放在恒温水浴锅中加热(如图1所示),按一定的液固比加入蒸馏水,开启搅拌器同时加入预定的氨水,待温度到达40℃时开始热解,此时滴加卤水(氯化镁溶液)并继续滴入氨水,保持10min时间后过滤洗涤,滤出的固体在120℃的温度条件下干燥得到碱式碳酸镁产品.
碱式碳酸镁密度小,是橡胶制品的优良填料.可用复盐MgCO3•(NH4)2CO3•H2O作原料制各.取一定量的含镁复盐放三颈烧瓶中,并将三颈烧瓶放在恒温水浴锅中加热(如图1所示),按一定的液固比加入蒸馏水,开启搅拌器同时加入预定的氨水,待温度到达40℃时开始热解,此时滴加卤水(氯化镁溶液)并继续滴入氨水,保持10min时间后过滤洗涤,滤出的固体在120℃的温度条件下干燥得到碱式碳酸镁产品.
(1)本实验选择水浴加热方式,其优点是使反应物受热均匀,温度容易控制.
(2)40℃时复盐开始热解生成MgCO3•3H2O,并有气体产生,该反应的化学方程式为MgCO3•(NH4)2CO3•H2O+H2O$\frac{\underline{\;\;△\;\;}}{\;}$MgCO3•3H2O+2NH3↑+CO2↑.
(3)碱式碳酸镁产品中镁的质量分数[w(Mg)%]越高,产品质最越好,氯的质量分数越高,产品质量越差.某科研小组用沉淀滴定法分析产品中C1-的含量,称取6.1000g产品用适量硝酸溶解,经稀释等步骤最终配得500mL的溶液.①在配制过程中必需要用到的一种计量仪器是电子天平或分析天平.准确最取25.00mL待测液,用硝酸银标准液进行滴定,滴定前后滴定管中的液面读数如图2所示,则滴定过程中消耗标准液的体积为16mL.
②已知某温度时,一些银盐的颜色和Ksp如下表:
则滴定时,可用作指示剂的是d.
a.CaCl2b.NaBr c.NaI d.K2CrO4
③滴定时,应将溶液调成中性,不能是强酸性或强碱性,其中不能是强碱性的原因是碱性条件下,硝酸银会生成氢氧化银或氧化银沉淀.
(4)已知制得的碱式碳酸镁可表示为xMgC03′yMg(OH)2H2O.若碱式碳酸镁的质量ag(不考虑微最杂质),充分灼烧后,测得剩余固体的质量为bg,产生的二氧他碳气体体积在标准状况下为cL,则碱式碳酸镁中x:y=40c:(22.4b-40c).(用b、c表示,不需化简)
 碱式碳酸镁密度小,是橡胶制品的优良填料.可用复盐MgCO3•(NH4)2CO3•H2O作原料制各.取一定量的含镁复盐放三颈烧瓶中,并将三颈烧瓶放在恒温水浴锅中加热(如图1所示),按一定的液固比加入蒸馏水,开启搅拌器同时加入预定的氨水,待温度到达40℃时开始热解,此时滴加卤水(氯化镁溶液)并继续滴入氨水,保持10min时间后过滤洗涤,滤出的固体在120℃的温度条件下干燥得到碱式碳酸镁产品.
碱式碳酸镁密度小,是橡胶制品的优良填料.可用复盐MgCO3•(NH4)2CO3•H2O作原料制各.取一定量的含镁复盐放三颈烧瓶中,并将三颈烧瓶放在恒温水浴锅中加热(如图1所示),按一定的液固比加入蒸馏水,开启搅拌器同时加入预定的氨水,待温度到达40℃时开始热解,此时滴加卤水(氯化镁溶液)并继续滴入氨水,保持10min时间后过滤洗涤,滤出的固体在120℃的温度条件下干燥得到碱式碳酸镁产品.(1)本实验选择水浴加热方式,其优点是使反应物受热均匀,温度容易控制.
(2)40℃时复盐开始热解生成MgCO3•3H2O,并有气体产生,该反应的化学方程式为MgCO3•(NH4)2CO3•H2O+H2O$\frac{\underline{\;\;△\;\;}}{\;}$MgCO3•3H2O+2NH3↑+CO2↑.
(3)碱式碳酸镁产品中镁的质量分数[w(Mg)%]越高,产品质最越好,氯的质量分数越高,产品质量越差.某科研小组用沉淀滴定法分析产品中C1-的含量,称取6.1000g产品用适量硝酸溶解,经稀释等步骤最终配得500mL的溶液.①在配制过程中必需要用到的一种计量仪器是电子天平或分析天平.准确最取25.00mL待测液,用硝酸银标准液进行滴定,滴定前后滴定管中的液面读数如图2所示,则滴定过程中消耗标准液的体积为16mL.
②已知某温度时,一些银盐的颜色和Ksp如下表:
| 难溶盐 | AgCl | AgBr | AgI | Ag2CrO4 |
| Ksp | 2×10-10 | 5.4×10-13 | 8.3×10-17 | 2×10-12 |
| 颜色 | 白色 | 淡黄色 | 黄色 | 砖红色 |
a.CaCl2b.NaBr c.NaI d.K2CrO4
③滴定时,应将溶液调成中性,不能是强酸性或强碱性,其中不能是强碱性的原因是碱性条件下,硝酸银会生成氢氧化银或氧化银沉淀.
(4)已知制得的碱式碳酸镁可表示为xMgC03′yMg(OH)2H2O.若碱式碳酸镁的质量ag(不考虑微最杂质),充分灼烧后,测得剩余固体的质量为bg,产生的二氧他碳气体体积在标准状况下为cL,则碱式碳酸镁中x:y=40c:(22.4b-40c).(用b、c表示,不需化简)
17.常温下不能用于鉴别浓硫酸和稀硫酸的是( )
| A. | 水 | B. | CuSO4晶体 | C. | 铝片 | D. | 铜片 |
16.X的化学式为C8H8,其结构可用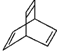 表示.下列说法不正确的是( )
表示.下列说法不正确的是( )
0 171250 171258 171264 171268 171274 171276 171280 171286 171288 171294 171300 171304 171306 171310 171316 171318 171324 171328 171330 171334 171336 171340 171342 171344 171345 171346 171348 171349 171350 171352 171354 171358 171360 171364 171366 171370 171376 171378 171384 171388 171390 171394 171400 171406 171408 171414 171418 171420 171426 171430 171436 171444 203614
 表示.下列说法不正确的是( )
表示.下列说法不正确的是( )| A. | X属于烃 | |
| B. | X能使酸性高锰酸钾溶液褪色 | |
| C. | X与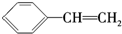 互为同分异构体 互为同分异构体 | |
| D. | X与足量的H2在一定条件下反应可生成环状的饱和烃Z,Z的一氯代物有4种 |