题目内容
1.制备过氧化氢的传统方法是在过氧化钡中加入稀硫酸.以重晶石(BaSO4)为原料制备过氧化氢的流程如图1: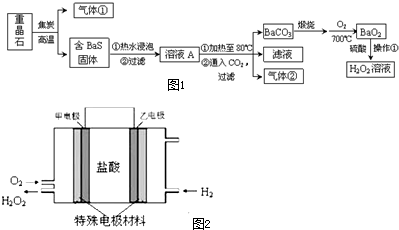
回答下列问题:
(1)图1中的气体①可能含有的物质是D
①CO ②CO2 ③SO2
A.仅①③B.仅②③C.仅①②D.全部
(2)BaS不能存在于水中,BaS溶于水后,S元素主要以HS-的形式存在,用化学方程式表示其原因:2BaS+2H2O?Ba(OH)2+Ba(HS)2.
(3)已知:Ba(OH)2(aq)+CO2(g)=BaCO3(s)+H2O(l)△H=-162kJ•mol-1
2H2S(g)+Ba(OH)2(aq)=Ba(HS)2(aq)+2H2O(l)△H=-191kJ•mol-1
写出CO2 和Ba(HS)2反应的热化学反应方程式:Ba(HS)2(aq)+CO2(g)+H2O(l)=BaCO3(s)+2 H2S(g)△H=+29kJ•mol-1.需将溶液A加热的原因是上述反应为吸热反应,加热可使平衡向正反应方向移动,提高BaCO3产率.
(4)气体②可进一步加工成为上述制取H2O2流程中的一种原料,该原料是H2SO4.
(5)通入的CO2若含有O2会有BaSO4生成,所以通常增大溶液的pH以提高CO32-浓度,把BaSO4转化为BaCO3.若测得SO42-的浓度为1×10-4mol•L-1,则CO32-的浓度需大于2.5×10-3 mol•L-1才不致于生成BaSO4沉淀,已知Ksp(BaSO4)=1×10-10,Ksp(BaCO3)=2.5×10-9
(6)据报道,科学家在实验室已研制出在燃料电池的反应容器中,利用特殊电极材料以H2和O2为原料制取过氧化氢的新工艺.原理如图2所示:请写出甲电极的电极反应式:2H++O2+2e-=H2O2.
分析 重晶石是BaSO4,由BaSO4和单质碳高温生成气体:BaSO4+4C$\frac{\underline{\;高温\;}}{\;}$BaS+4CO↑.碳、一氧化碳高温燃烧生成气体CO2,BaS溶于H2O遇二氧化碳反应:BaS+H2O+CO2=BaCO3↓+H2S,硫化氢燃烧生成二氧化硫,含BaS的固体热水浸泡,2BaS+2H2O?Ba(OH)2+Ba(HS)2,过滤得到溶液A,通二氧化碳:Ba(HS)2+CO2+H2O=BaCO3↓+2H2S,Ba(OH)2+CO2=BaCO3↓+H2O,气体②为硫化氢,BaCO3$\frac{\underline{\;高温\;}}{\;}$BaO+CO2↑,2BaO+O2$\frac{\underline{\;300℃\;}}{\;}$2BaO2,BaO2+H2SO4=BaSO4↓+H2O2.
(1)生产过程中会产生大量废气(主要成分为CO2、CO及少量SO2和硫蒸气等);
(2)在溶液中,硫离子水解导致溶液显示碱性;
(3)根据盖斯定律书写CO2 和Ba(HS)2反应的热化学反应方程式,根据影响化学平衡因素分析需将溶液A加热的原因;
(4)BaS不能存在于水中,BaS溶于水后,S元素主要以HS-的形式存在,故溶液A中存在大量Ba2+和HS-,和H2O、CO2反应生成CaCO3、H2S气体,即气体B的主要成分为H2S气体,H2S气体可用来制造H2SO4;
(5)根据溶解平衡常数计算;
(6)电极方程式的书写:先写出反应物、产物、电子,根据电荷守恒写出H+,原子守恒配平.
解答 解:(1)由BaSO4和单质碳高温生成气体:BaSO4+4C$\frac{\underline{\;高温\;}}{\;}$BaS+4CO↑.碳、一氧化碳高温燃烧生成气体CO2,BaS溶于H2O遇二氧化碳反应:BaS+H2O+CO2=BaCO3↓+H2S,硫化氢燃烧生成二氧化硫,所以图1中的气体①可能①CO②CO2③SO2都有,
故答案为:D;
(2)在硫化钡中,硫离子水解而使得硫化钡显碱性,有碱Ba(OH)2生成,硫离子水解生成HS-,即2BaS+2H2O?Ba(OH)2+Ba(HS)2,
故答案为:2BaS+2H2O?Ba(OH)2+Ba(HS)2;
(3)Ba(OH)2(aq)+CO2(g)=BaCO3(s)+H2O(l)△H=-162kJ•mol-1①
2H2S(g)+Ba(OH)2(aq)=Ba(HS)2(aq)+2H2O(l)△H=-191kJ•mol-1②根据盖斯定律将①-②得:Ba(HS)2(aq)+CO2(g)+H2O(l)=BaCO3(s)+2 H2S(g)△H=+29kJ•mol-1,该反应为吸热反应,加热可使平衡向正反应方向移动,提高BaCO3产率,
故答案为:Ba(HS)2(aq)+CO2(g)+H2O(l)=BaCO3(s)+2 H2S(g)△H=+29kJ•mol-1;上述反应为吸热反应,加热可使平衡向正反应方向移动,提高BaCO3产率;
(4)BaS不能存在于水中,BaS溶于水后,S元素主要以HS-的形式存在,故溶液A中存在大量Ba2+和HS-,和H2O、CO2反应生成CaCO3、H2S气体,即气体B的主要成分为H2S气体,H2S气体和与氧气反应生成二氧化硫、二氧化硫和氧气反应生成三氧化硫,三氧化硫和水反应生成硫酸,所以硫化氢可用来制造H2SO4,
故答案为:H2SO4;
(5)有BaSO4沉淀的溶液中:Ksp(BaSO4)=cC(Ba2+)•C(SO42-)=1×10-10,若测得SO42-的浓度为1×10-4mol•L-1,则:cC(Ba2+)=$\frac{{K}_{SP}(BaS{O}_{4})}{C(S{{O}_{4}}^{2-})}$=$\frac{1×1{0}^{-10}}{1×1{0}^{-4}}$=1×10-6mol•L-1,即该溶液中Ba2+的浓度为1×10-6mol•L-1,要生成BaCO3沉淀,需要满足cC(Ba2+)•C(CO32-)≥Ksp(BaCO3)=2.5×10-9
C(CO32-)≥$\frac{{K}_{SP}(BaC{O}_{3})}{C(B{a}^{2+})}$=$\frac{2.5×1{0}^{-9}}{1×1{0}^{-6}}$=2.5×10-3mol•L-1;
故答案为:2.5×10-3mol•L-1;
(6)据图2所示甲电极上消耗O2,生成H2O2,1molO2生成1molH2O2时失去2mol电子,电解质溶液为盐酸,酸性条件下,离子反应方程式为:2H++O2+2e-=H2O2;
故答案为:2H++O2+2e-=H2O2.
点评 本题以重晶石(BaSO4)为原料制备过氧化氢为载体,考查物质推断、热化学方程式的书写、水解化学方程式书写、沉淀转化的有关知识以及电极方程式的书写等,是对所学知识的综合运用与能力的考查,根据已有知识结合工艺流程推断物质及发生反应是解题关键,题目难度中等.

| A. | 酸的水溶液呈酸性;则有酸性的水溶液也一定是酸的水溶液 | |
| B. | Fe3O4可写成FeO?Fe2O3;Pb3O4也可写成PbO?Pb2O3 | |
| C. | 可电解熔融MgCl2来制取金属镁;也能电解熔融HCl来制取氢气 | |
| D. | 第2周期元素氢化物稳定性顺序是HF>H2O>NH3;则第3周期元素氢化物稳定性顺序是HCl>H2S>PH3 |
| A. | 氯水 | B. | 烧碱 | C. | 纯碱 | D. | 漂白粉 |

| 物质 | 熔点/℃ | 沸点/℃ |
| PCl3 | -112 | 75.5 |
| POCl3 | 2 | 105.3 |
(1)仪器乙的名称蒸馏烧瓶;
(2)冷凝管中的冷却水从a口进(填“a”或“b”);
(3)写出实验室制氯气的离子方程式MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O;
(4)向仪器甲中通入干燥Cl2之前,应先通入一会干燥CO2,其目的是排尽甲装置中的空气,防止生成的PCl3与空气中的O2和H2O反应;
(5)碱石灰的作用是吸收多余氯气防止污染空气,防止空气中的水蒸气进入烧瓶中与PCl3反应;
(6)已知PCl5遇水发生强烈水解生成两种酸,写出PCl5与水反应的化学方程式PCl5+4H2O═5HCl+H3PO4;
(7)粗产品中常含有POCl3、PCl5等.加入黄磷加热除去PCl5后,通过蒸馏(填实验操作名称),即可得到纯净的PCl3;
(8)测定产品中PCl3的质量分数:迅速称取ag产品,加水反应后配成250mL溶液,取出25.00mL加入过量的c1mol•L-1V1mL碘溶液,充分反应后再用c2mol•L-1Na2S2O3溶液滴定过量的碘,终点时消耗V2mLNa2S2O3溶液.已知:H3PO3+H2O+I2=H3PO4+2H1:I2+2Na2S2O3=2Na1+Na2S4O6;假设测定过程中没有其他反应.根据上述数据:该产品中PC13的质量分数为$\frac{({c}_{1}{V}_{1}-\frac{1}{2}{C}_{2}{V}_{2})×1{0}^{-3}×137.5×10}{a}$×100%(用含字母的代数式表示).
| A. | 3-甲基-2-戊炔 | B. | 3-甲基-2-丁醇 | C. | 3-甲基-1-丁炔 | D. | 2,2-二甲基丁烷 |
| A. | 羟基的电子式: | B. | 石炭酸的结构简式:C6H5OH | ||
| C. | 乙醛的分子式:C2H4O | D. | 酚醛树脂的结构简式为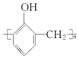 |
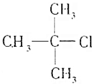 、④
、④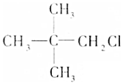 、⑤
、⑤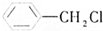 、⑥
、⑥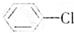 .
.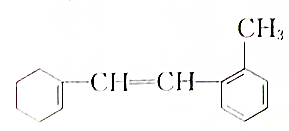 [典型例题√某有机物的结构简式如图:
[典型例题√某有机物的结构简式如图: