题目内容
8.短周期元素在周期表中的位置关系如图所示.| X | ||
| Y | ||
| Z |
(2)Y与氢化合形成的化合物的结构式为H-F,在同主族元素的氢化物分子中,该氢化物分子中共价键键能最大,原因是同主族中F原子半径最小,故H-F键长最短,H-F键最稳定,H-F键能最大.
(3)Z单质的晶体属于分子晶体,Z的氢化物的电子式是
 ,该分子中含2个σ键,0个π键(若不含填0).
,该分子中含2个σ键,0个π键(若不含填0).
分析 由短周期元素的位置,可知X是He,Y是F元素,Z是S元素.
(1)稀有气体为单原子分子;计算X原子的质量数,摩尔质量与质量数在数值上相等;
(2)Y与氢化合形成的化合物为HF,键长越短,共价键越稳定,键能越大;
(3)硫单质属于分子晶体,硫的氢化物为H2S,分子中F原子与H原子之间形成1对共用电子对.
解答 解:由短周期元素的位置,可知X是He,Y是F元素,Z是S元素.
(1)稀有气体为单原子分子,X元素的单质的分子式是He;若X核内中子数与质子数相等,则其质量数=2+2=4,故其摩尔质量为4g/mol,故答案为:He;4g/mol;
(2)Y与氢化合形成的化合物为HF,结构式为H-F,同主族中F原子半径最小,故H-F键长最短,H-F键最稳定,H-F键能最大,故答案为:H-F;同主族中F原子半径最小,故H-F键长最短,H-F键最稳定,H-F键能最大;
(3)硫单质属于分子晶体,硫的氢化物为H2S,分子中F原子与H原子之间形成1对共用电子对,电子式为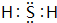 ,该分子中含2个σ键,没有π键,故答案为:分子晶体;
,该分子中含2个σ键,没有π键,故答案为:分子晶体;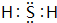 ;2;0.
;2;0.
点评 本题考查元素周期表、化学键、电子式等,比较基础,旨在考查学生对基础知识的理解掌握.

练习册系列答案
相关题目
15.下列物质的分类合理的是( )
| A. | 碱性氧化物:Na2O、CO、Al2O3、Na2O2 | B. | 碱:NaOH、KOH、Ba(OH)2、Na2CO3 | ||
| C. | 氧化物:Fe2O3、NO、SO2、H2O | D. | 电解质:KNO3、Cl2、HCl、BaSO4 |
16.下列有关NaHCO3和Na2CO3的性质比较中,不正确的是( )
| A. | 热稳定性:Na2CO3>NaHCO3 | |
| B. | 常温时,在水中的溶解度:Na2CO3>NaHCO3 | |
| C. | 等物质的量的NaHCO3和Na2CO3与足量稀盐酸反应产生CO2的质量:Na2CO3<NaHCO3 | |
| D. | NaHCO3和Na2CO3溶液的物质的量浓度相同时,溶液的pH:Na2CO3>NaHCO3 |
13.下列各物质的名称不正确的是( )
| A. | 3-甲基-2-戊炔 | B. | 3-甲基-2-丁醇 | C. | 3-甲基-1-丁炔 | D. | 2,2-二甲基丁烷 |
20.下列反应属于取代反应的是( )
| A. | Zn+CuSO4 ═ZnSO4+Cu | B. | NaCl+AgNO3═NaNO3+AgCl↓ | ||
| C. | CH3OH+HCOOH→HCOOCH3+H2O | D. | CH4+2Br2 $\stackrel{光照}{→}$ CH2Br2+2HBr |
17.在一定温度下的定容密闭容器中,下列条件不能表明2A(s)?C(g)+D(g)已达到平衡状态的是( )
| A. | 混合气体的压强不再改变 | |
| B. | 气体C在混合气体中所占的物质的量分数不再改变 | |
| C. | 混合气体的密度不再改变 | |
| D. | 单位时间内消耗n mol C的同时消耗2n mol A |
18.用NA表示阿伏伽德罗常数,下列有关说法正确的是( )
| A. | lmol OH一中含有9 NA个电子 | |
| B. | 46g NO2和N2O4混合物中所含原子数目为3NA | |
| C. | 常温常压下50g 46%的乙醇溶液中,所含氧原子数目为0.5NA | |
| D. | .常温下,56g铁粉与足量浓硝酸反应,电子转移数目小于3NA |
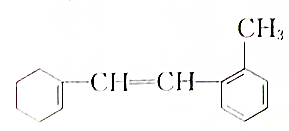 [典型例题√某有机物的结构简式如图:
[典型例题√某有机物的结构简式如图: