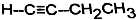题目内容
4.下面是一些实验室制备硫酸铜的实验设计.实验一:用铜与浓硫酸反应制取硫酸铜.
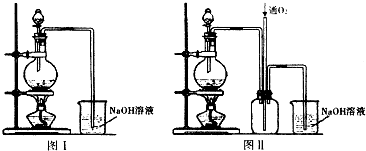
实验二:将适量浓硝酸分多次加入到铜粉与稀硫酸的混合物中,加热使之反应完全制取硫酸铜.(装置如下图中的图I.图Ⅱ).
实验三:将铜粉在某仪器中反复灼烧,使铜粉充分与空气发生反应生成氧化铜,再将氧化铜与稀硫酸反应,经后续步骤可得到硫酸铜晶体.
实验四:向铜粉和稀硫酸的混合物中加入H2O得到硫酸铜.
请回答实验中的有关问题.
(1)实验一中发生反应的化学反应方程式为Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O,这种方法的缺点是生成物对环境造成污染.
(2)实验二装置图中分液漏斗里盛装的液体是浓硝酸.图Ⅱ是图I的改进装置,分析图II装置的优点是有利于氮氧化合物的吸收、防止倒吸.
(3)实验三中用于灼烧的仪器名称是坩埚.该实验中的后续步骤指的是蒸发浓缩、冷却结晶、过滤、洗涤、干燥.
(4)实验四中发生反应的化学方程式为Cu+H2O2+H2SO4=CuSO4+2H2O.
(5)除上面的实验设计外,请你再设计一种只用铜和稀硫酸为原料制取硫酸铜的方法(写出化学反应方程式).Cu+H2SO4$\frac{\underline{\;电解\;}}{\;}$CuSO4+H2↑.
分析 (1)铜与浓硫酸反应生成硫酸铜和二氧化硫;
(2)实验中将适量浓硝酸分多次加入到铜粉与稀硫酸的混合物中,判断分液漏斗中装的液体;在尾气吸收装置之前连接集气瓶,通入氧气有利于氮氧化合物的吸收,同时起安全瓶作用;
(3)高温灼烧固体应在坩埚中进行;通过蒸发、结晶得到硫酸铜晶体;
(4)铜与双氧水、硫酸反应生成硫酸铜;
(5)一般条件下,铜与稀硫酸不反应,必须在外加电场的作用下让其反应.所以得设计一个电解池来完成.
解答 解:(1)铜与浓硫酸反应生成硫酸铜和二氧化硫:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O,二氧化硫污染环境,故答案为:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O;生成物对环境造成污染;
(2)由题目信息,实验中将适量浓硝酸分多次加入到铜粉与稀硫酸的混合物中,故分液漏斗中装的液体为浓硝酸;反应中产生的尾气主要为NO,由于NO与NaOH溶液不反应,故应向氢氧化钠溶液中通入空气(氧气),图II装置中在尾气吸收装置之前连接集气瓶,通入氧气有利于氮氧化合物的吸收,同时起安全瓶作用,防止倒吸,
故答案为:浓硝酸;有利于氮氧化合物的吸收、防止倒吸;
(3)高温灼烧固体应在坩埚中进行,因此仪器应为坩埚;通过蒸发浓缩、冷却结晶、过滤、洗涤、干燥得到硫酸铜晶体,故答案为:坩埚;蒸发浓缩、冷却结晶、过滤、洗涤、干燥;
(4)铜与双氧水、硫酸反应生成硫酸铜,化学方程式为:Cu+H2O2+H2SO4=CuSO4+2H2O,故答案为:Cu+H2O2+H2SO4=CuSO4+2H2O;
(5)铜与稀硫酸不反应,必须在外加电场的作用下让其反应,可以设计一个电解池,化学反应方程式:Cu+H2SO4$\frac{\underline{\;电解\;}}{\;}$CuSO4+H2↑,故答案为:Cu+H2SO4$\frac{\underline{\;电解\;}}{\;}$CuSO4+H2↑.
点评 本题考查硫酸铜制备实验方案的设计,明确装置的作用及发生的氧化还原反应是解答本题的关键,注意除杂的方法及物质的成分、性质的差异来解答,综合性较强,题目难度较大.

| A. | 溶液中含有H+ | B. | 滴入酚酞试液后,溶液呈红色 | ||
| C. | c(OH-)>c(H+)的溶液 | D. | 与金属铁反应放出氢气 |
| A. | 由CO2和O2组成的混合物共有NA个分子,其中的氧原子数为2NA | |
| B. | 62gNa2O溶于水,所得溶液中含有的O2-为NA | |
| C. | 0.5 mol•L-1的Ba(OH)2溶液中OH-的数目为NA | |
| D. | 在常温常压下,2.24L氨气中所含的分子总数为0.1NA |
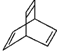 表示.下列说法不正确的是( )
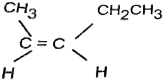
表示.下列说法不正确的是( )| A. | X属于烃 | |
| B. | X能使酸性高锰酸钾溶液褪色 | |
| C. | X与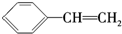 互为同分异构体 互为同分异构体 | |
| D. | X与足量的H2在一定条件下反应可生成环状的饱和烃Z,Z的一氯代物有4种 |
①除去乙烷中少量的乙烯:光照条件下通入Cl2,气液分离; ②除去福尔马林中的乙酸,加入足量饱和碳酸钠溶液充分振荡蒸馏,收集馏出物 ③除去CO2中少量的SO2;气体通过盛有饱和碳酸钠溶液的洗气瓶; ④除去乙醇中少量的乙酸:加足量生石灰,蒸馏.
| A. | ①② | B. | ②④ | C. | ③④ | D. | ②③ |
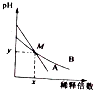 室温下,pH相差1的两种一元碱溶液A和B,分别加水稀释时,溶液的pH变化如图所示,下列说法正确的是( )
室温下,pH相差1的两种一元碱溶液A和B,分别加水稀释时,溶液的pH变化如图所示,下列说法正确的是( )| A. | 稀释前,c(A)=10c(B) | |
| B. | 在M点,A、B两种碱溶液中阳离子的物质的量浓度相等 | |
| C. | 稀释前,A溶液中由水电离出的OH-的浓度大于10-7mol/L | |
| D. | 由图可知,A为强碱,B为弱碱 |
| A. | 使用高效低毒的农药,既能提高作物产量,又能降低农药残留量 | |
| B. | 食品包装袋中常放入生石灰作为抗氧化剂,防止食品变质 | |
| C. | 水瓶胆中的水垢可用饱和食盐水清洗 | |
| D. | 明矾可用于净水,也可用于淡化海水 |