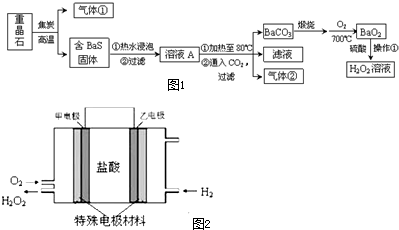
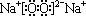题目内容
6.半导体生产的外延生长工序中,常需要控制掺杂,以保证控制电阻率,其中三氯化磷(PCl3)是一种重要的掺杂剂.实验室要用黄磷与干燥的Cl2模拟工业生产制取PCl3,用图1装置制取Cl2,图2装置制取PCl3,部分仪器已省略.已知黄磷与少量Cl2反应生成PCl3.与过量Cl2反应生成PCl5、PCl3遇O2会生成POCl3、POCl3溶于PCl3,PCl3遇水会强烈水解生成H3PO3和HCl.
| 物质 | 熔点/℃ | 沸点/℃ |
| PCl3 | -112 | 75.5 |
| POCl3 | 2 | 105.3 |
(1)仪器乙的名称蒸馏烧瓶;
(2)冷凝管中的冷却水从a口进(填“a”或“b”);
(3)写出实验室制氯气的离子方程式MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O;
(4)向仪器甲中通入干燥Cl2之前,应先通入一会干燥CO2,其目的是排尽甲装置中的空气,防止生成的PCl3与空气中的O2和H2O反应;
(5)碱石灰的作用是吸收多余氯气防止污染空气,防止空气中的水蒸气进入烧瓶中与PCl3反应;
(6)已知PCl5遇水发生强烈水解生成两种酸,写出PCl5与水反应的化学方程式PCl5+4H2O═5HCl+H3PO4;
(7)粗产品中常含有POCl3、PCl5等.加入黄磷加热除去PCl5后,通过蒸馏(填实验操作名称),即可得到纯净的PCl3;
(8)测定产品中PCl3的质量分数:迅速称取ag产品,加水反应后配成250mL溶液,取出25.00mL加入过量的c1mol•L-1V1mL碘溶液,充分反应后再用c2mol•L-1Na2S2O3溶液滴定过量的碘,终点时消耗V2mLNa2S2O3溶液.已知:H3PO3+H2O+I2=H3PO4+2H1:I2+2Na2S2O3=2Na1+Na2S4O6;假设测定过程中没有其他反应.根据上述数据:该产品中PC13的质量分数为$\frac{({c}_{1}{V}_{1}-\frac{1}{2}{C}_{2}{V}_{2})×1{0}^{-3}×137.5×10}{a}$×100%(用含字母的代数式表示).
分析 实验室要用黄磷(白磷)与干燥的Cl2模拟工业生产制取PCl3流程为:A装置浓盐酸和二氧化锰二者反应生成氯化锰、氯气和水,制得氯气,因PCl3遇水会强烈水解,所以氯气需干燥,B装置利用浓硫酸干燥氯气,K3利用二氧化碳排尽装置中的空气,防止黄磷(白磷)自燃,PCl3沸点为75.5℃,利用E装置防止PCl3挥发(冷凝),蒸馏烧瓶乙中得到的粗产品含有POCl3、PCl5等.加入黄磷加热除去PCl5后,POCl3与PCl3都是液体,沸点相差较大,故可以用蒸馏的方法进行分离,因尾气中含有有毒气体氯气,且空气中水蒸气可能进入装置,所以用F装置利用碱石灰吸收多余的Cl2,防止空气中的水蒸气进入烧瓶和PCl3反应.
(1)仪器乙为蒸馏烧瓶;
(2)为充分冷凝,使冷水充满冷凝器,因此冷却水采取逆流原理;
(3)A装置中二氧化锰和浓盐酸反应制取氯气,反应为MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,据此书写离子反应方程式;
(4)由于PCl3遇O2、遇水都会反应,所以通入一段时间的CO2可以排尽装置中的空气,避免水和氧气与三氯化磷发生反应;
(5)碱石灰吸收多余氯气防止污染空气,防止空气中的水蒸气进入影响产品纯度;
(6)PCl5遇水发生强烈水解生成两种酸,水解生成氯化氢和磷酸;
(7)依据物质的沸点数值不同,可以利用蒸馏的方法分离出三氯化磷;
(8)依据反应的化学方程式H3PO3+H2O+I2=H3PO4+2HI;I2+2Na2S2O3=2NaI+Na2S4O6 计算,注意溶液体积的变化.
解答 解:(1)仪器乙烧瓶带有支管口,为蒸馏烧瓶,蒸馏烧瓶乙中得到的粗产品含有POCl3、PCl5等,加入黄磷加热除去PCl5后,POCl3与PCl3都是液体,沸点相差较大,故可以用蒸馏的方法进行分离,
故答案为:蒸馏烧瓶;
(2)冷凝管应从下口进水,上口出水,以保证水充满冷凝管,起到充分冷凝的作用,所以冷却水从a口进入,
故答案为:a;
(3)A装置中,加热条件下,浓盐酸和二氧化锰二者反应生成氯化锰、氯气和水,离子方程式为MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O,
故答案为:MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O;
(4)由于PCl3遇O2会生成POCl3,遇水生成H3PO3和HCl,通入一段时间的CO2可以排尽装置中的空气,防止生成的PCl3与空气中的O2和水反应;
故答案为:排尽甲装置中的空气,防止生成的PCl3与空气中的O2和H2O反应;
(5)氯气有毒,污染空气,碱石灰吸收多余氯气防止污染空气,防止空气中的水蒸气进入影响产品纯度,
故答案为:吸收多余氯气防止污染空气,防止空气中的水蒸气进入烧瓶中与PCl3反应;
(6)PCl5遇水发生强烈水解生成两种酸,PCl5水解的实质是磷离子和氢氧根离子结合,氯离子和氢离子结合,即PCl5+4H2O═5HCl+H3PO4,
故答案为:PCl5+4H2O═5HCl+H3PO4;
(7)由信息可知,POCl3与PCl3都是液体,沸点相差较大,故可以用蒸馏的方法进行分离,
故答为:蒸馏;
(8)H3PO3+H2O+I2=H3PO4+2HI;I2+2Na2S2O3=2NaI+Na2S4O6,依据化学方程式可知H3PO3物质的量和PCl3的物质的量相同,25ml溶液中和H3PO3反应的碘单质物质的量为c1mol•L-lV1mL×10-3-$\frac{1}{2}$×c2mol•L-1×V2mL;所以250ml溶液中H3PO3物质的量=碘单质物质的量为(c1mol•L-lV1mL×10-3-$\frac{1}{2}$×c2mol•L-1×V2mL)×10,
该产品中PCl3的质量分数为:$\frac{({c}_{1}{V}_{1}-\frac{1}{2}{C}_{2}{V}_{2})×1{0}^{-3}×137.5×10}{a}$×100%,
故答案为:$\frac{({c}_{1}{V}_{1}-\frac{1}{2}{C}_{2}{V}_{2})×1{0}^{-3}×137.5×10}{a}$×100%.
点评 本题考查阅读获取信息的能力、对实验原理理解等,题目难度中等,是对知识的综合运用,需要学生具有扎实的基础与综合运用分析解决问题的能力,注意题中信息PCl3遇O2会生成POCl3,POCl3溶于PCl3,PCl3遇水会强烈水解生成H3PO3和HCl.PCl3、POCl3的熔沸点为解答关键.

| A. | NaI→AgI | B. | CO2→CO | C. | Cl2→Ca(C1O)2 | D. | Na→NaOH |
| A. | Cl2溶于水 | |
| B. | NH3溶于水 | |
| C. | 可充电电池的反应如H2O+Zn+Ag2O$?_{充电}^{放电}$Zn(OH)2+Ag | |
| D. | 电解水生产H2和O2,点燃H2和O2的混合物生产水 |
| A. | 离子化合物可能含共价键 | |
| B. | 全部由非金属元素形成的化合物一定是共价化合物 | |
| C. | 离子化合物中只含离子键 | |
| D. | 离子化合物中一定含有金属离子 |
| A. | 用CH3COOH溶解CaCO3:CaCO3+2H+=Ca2++H2O+CO2↑ | |
| B. | 钠与CuSO4溶液反应:2Na+Cu2+═Cu↓+2Na+ | |
| C. | AlCl3溶液中加入过量稀氨水:Al3++4NH3•H2O═AlO2-+4NH4++2H2O | |
| D. | 用双氧水和稀硫酸处理印刷电路板:Cu+H2O2+2H+=Cu2++2H2O |
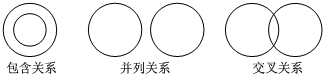
| A. | 化合反应与氧化反应属于包含关系 | |
| B. | 吸热反应与放热反应属于交叉关系 | |
| C. | 复分解反应与中和反应属于包含关系 | |
| D. | 含氧化合物与氧化物属于并列关系 |
| A. | 0.2mol•L一1NaOH溶液中:NH4+、Na+、SO42-、CO32- | |
| B. | 1.0mol•L-1的KNO3溶液:H+、Fe2+、Cl-、SO42- | |
| C. | 能使紫色石蕊变红的溶液:Ca2+、Na+、Cl-、NO3- | |
| D. | 无色溶液中:K+、Na+、Cr2O72-、Cl- |
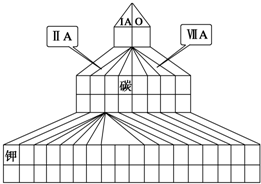 如图是元素周期表的另一种画法-塔式周期表,在上面标有部分族序数及部分元素,请回答下列问题:
如图是元素周期表的另一种画法-塔式周期表,在上面标有部分族序数及部分元素,请回答下列问题: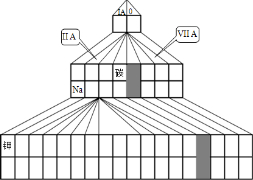
 或
或