1.某校化学实验兴趣小组在“探究卤素单质的氧化性”的系列实验中发现:在足量的稀氯化亚铁溶液中,加入1~2滴溴水,振荡后溶液呈黄色.
(1)提出问题:Fe3+、Br2哪一个的氧化性更强?
(2)猜想
①甲同学认为氧化性:Fe3+>Br2,故上述实验现象不是发生化学反应所致,则溶液呈黄色是含Br2(填化学式,下同)所致.
②乙同学认为氧化性:Br2>Fe3+,故上述实验现象是发生化学反应所致,则溶液呈黄色是含Fe3+所致.
(3)设计实验并验证
丙同学为验证乙同学的观点,选用下列某些试剂设计出两种方案进行实验,并通过观察实验现象,证明了乙同学的观点确实是正确的.供选用的试剂:
a.酚酞试液 b.CCl4 c.无水酒精 d.KSCN溶液
请你在下列表格中写出丙同学选用的试剂及实验中观察到的现象.(试剂填序号)
(4)应用与拓展
①在足量的稀氯化亚铁溶液中加入l~2滴溴水,溶液呈黄色,所发生的离子反应方程式为2Fe2++Br2═2Fe3++2Br-.
②在FeBr2溶液中通入足量 Cl2,所发生的离子反应方程式为4Fe2++2Br-+3Cl2═4Fe3++Br2+6Cl-.
(1)提出问题:Fe3+、Br2哪一个的氧化性更强?
(2)猜想
①甲同学认为氧化性:Fe3+>Br2,故上述实验现象不是发生化学反应所致,则溶液呈黄色是含Br2(填化学式,下同)所致.
②乙同学认为氧化性:Br2>Fe3+,故上述实验现象是发生化学反应所致,则溶液呈黄色是含Fe3+所致.
(3)设计实验并验证
丙同学为验证乙同学的观点,选用下列某些试剂设计出两种方案进行实验,并通过观察实验现象,证明了乙同学的观点确实是正确的.供选用的试剂:
a.酚酞试液 b.CCl4 c.无水酒精 d.KSCN溶液
请你在下列表格中写出丙同学选用的试剂及实验中观察到的现象.(试剂填序号)
| 选用试剂 | 实验现象 | |
| 方案1 | b | 下层(CCl4层)无色 |
| 方案2 | d | 溶液变为血红色 |
①在足量的稀氯化亚铁溶液中加入l~2滴溴水,溶液呈黄色,所发生的离子反应方程式为2Fe2++Br2═2Fe3++2Br-.
②在FeBr2溶液中通入足量 Cl2,所发生的离子反应方程式为4Fe2++2Br-+3Cl2═4Fe3++Br2+6Cl-.
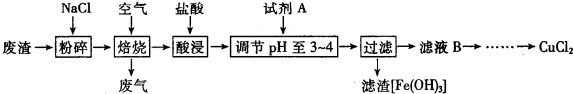
20.高铁酸盐(K2FeO4)在能源、环保等方面有着广泛的用途.湿法、干法制备高铁酸盐的原理如下表所示.
(1)写出干法制备K2FeO4 的化学方程式为,Fe2O3+3KNO3+4KOH$\frac{\underline{\;\;△\;\;}}{\;}$2K2FeO4+3KNO2+2H2O,该反应中氧化剂与还原剂的物质的量之比为3:1.
(2)高铁酸钾在水中既能消毒杀菌,又能净水,是一种理想的水处理剂.它能消毒杀菌是因为高铁酸钾有强氧化性,它能净水的原因是高铁酸钾与水反应生成的Fe(OH)3胶体有吸附性.
(3)在实验室配置Fe(NO3)3溶液时,若用蒸馏水直接配置,所得溶液往往较混浊,其原因是(用离子方程式表示)Fe3++3H2O?Fe(OH)3+3H+,因此,正确的配置操作是在溶液中加入少量的(填试剂名称)硝酸,其目的是抑制铁离子的水解.
(4)Fe2O3是一种红棕色的氧化物,写出它和盐酸反应的离子方程式Fe2O3+6H+=3H2O+2Fe3+.
(5)检验Fe3+ 的方法很多,写出其中的一种检验方法取少量溶液于试管中,加入少量KSCN溶液,如果变成血红色溶液,则含有Fe3+.
| 湿法 | 强碱性介质中,Fe(NO3)3与NaClO反应生成紫红色高铁酸盐溶液 |
| 干法 | Fe2O3、KNO3、KOH混合加热共熔生成紫红色高铁酸盐和KNO2等产物 |
(2)高铁酸钾在水中既能消毒杀菌,又能净水,是一种理想的水处理剂.它能消毒杀菌是因为高铁酸钾有强氧化性,它能净水的原因是高铁酸钾与水反应生成的Fe(OH)3胶体有吸附性.
(3)在实验室配置Fe(NO3)3溶液时,若用蒸馏水直接配置,所得溶液往往较混浊,其原因是(用离子方程式表示)Fe3++3H2O?Fe(OH)3+3H+,因此,正确的配置操作是在溶液中加入少量的(填试剂名称)硝酸,其目的是抑制铁离子的水解.
(4)Fe2O3是一种红棕色的氧化物,写出它和盐酸反应的离子方程式Fe2O3+6H+=3H2O+2Fe3+.
(5)检验Fe3+ 的方法很多,写出其中的一种检验方法取少量溶液于试管中,加入少量KSCN溶液,如果变成血红色溶液,则含有Fe3+.
12.S2Cl2是工业上常用的硫化剂,实验室制备S2Cl2的方法有2种:
①CS2+3Cl2 $\stackrel{111-140℃}{→}$ CCl4+S2Cl2;②2S+Cl2 $\stackrel{95-100℃}{→}$ S2Cl2.
已知S2Cl2中硫元素显+1价,电子式: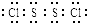 ,它不稳定,在水中易发生岐化反应(一部分硫元素价态升高,一部分降低).反应涉及的几种物质的熔沸点如下:
,它不稳定,在水中易发生岐化反应(一部分硫元素价态升高,一部分降低).反应涉及的几种物质的熔沸点如下:
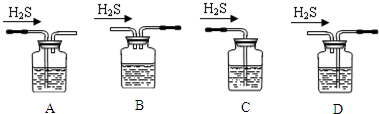
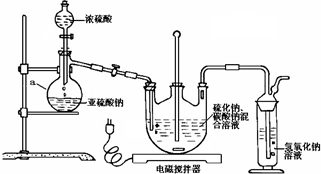
实验室利用下列装置制备S2Cl2(部分夹持仪器已略去):

回答下列问题:
(1)装置B、C中玻璃容器的名称:广口瓶;反应原理(填写数字序号):①.
(2)实验中盐酸试剂通常采用36.5%的浓溶液,不用稀盐酸的理由是稀盐酸还原性弱,反应困难.
(3)D中冷凝管起到导气和冷凝双重作用,其冷却水流动方向与热气流流动方向相同(见图).这种冷却方式可应用于下列高中化学中BD实验.
A.石油分馏 B.制取溴苯 C.制取乙酸乙酯 D.制备阿司匹林
(4)B装置中盛放的是饱和食盐水,反应结束后从锥形瓶内混合物中分离出产品的方法是蒸馏,D中采用热水浴加热的原因是使CS2平稳汽化,避免产物S2Cl2汽化.
(5)A部分仪器装配时,放好铁架台后,应先固定酒精灯(填仪器名称),整套装置装配完毕后,应先进行气密性检查再添加试剂.实验完毕,A中不再产生氯气时,可拆除装置.拆除时,最先的操作应当是将E中长导管移开液面.
(6)实验过程中,若缺少C装置,则发现产品浑浊不清,出现该现象的原因可用化学方程式表示为2S2Cl2+2H2O=3S↓+SO2↑+4HCl↑.实验完毕,当把剩余浓盐酸倒入E烧杯中与吸收了尾气的氢氧化钠溶液混合时,发现有少量黄绿色刺激性气体产生,产生该现象的原因是:ClO-+2H++Cl-=Cl2↑+H2O(用离子方程式表示).
0 171142 171150 171156 171160 171166 171168 171172 171178 171180 171186 171192 171196 171198 171202 171208 171210 171216 171220 171222 171226 171228 171232 171234 171236 171237 171238 171240 171241 171242 171244 171246 171250 171252 171256 171258 171262 171268 171270 171276 171280 171282 171286 171292 171298 171300 171306 171310 171312 171318 171322 171328 171336 203614
①CS2+3Cl2 $\stackrel{111-140℃}{→}$ CCl4+S2Cl2;②2S+Cl2 $\stackrel{95-100℃}{→}$ S2Cl2.
已知S2Cl2中硫元素显+1价,电子式:
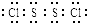 ,它不稳定,在水中易发生岐化反应(一部分硫元素价态升高,一部分降低).反应涉及的几种物质的熔沸点如下:
,它不稳定,在水中易发生岐化反应(一部分硫元素价态升高,一部分降低).反应涉及的几种物质的熔沸点如下:| 物质 | S | CS2 | CCl4 | S2Cl2 |
| 沸点/℃ | 445 | 47 | 77 | 137 |
| 熔点/℃ | 113 | -109 | -23 | -77 |

回答下列问题:
(1)装置B、C中玻璃容器的名称:广口瓶;反应原理(填写数字序号):①.
(2)实验中盐酸试剂通常采用36.5%的浓溶液,不用稀盐酸的理由是稀盐酸还原性弱,反应困难.
(3)D中冷凝管起到导气和冷凝双重作用,其冷却水流动方向与热气流流动方向相同(见图).这种冷却方式可应用于下列高中化学中BD实验.
A.石油分馏 B.制取溴苯 C.制取乙酸乙酯 D.制备阿司匹林
(4)B装置中盛放的是饱和食盐水,反应结束后从锥形瓶内混合物中分离出产品的方法是蒸馏,D中采用热水浴加热的原因是使CS2平稳汽化,避免产物S2Cl2汽化.
(5)A部分仪器装配时,放好铁架台后,应先固定酒精灯(填仪器名称),整套装置装配完毕后,应先进行气密性检查再添加试剂.实验完毕,A中不再产生氯气时,可拆除装置.拆除时,最先的操作应当是将E中长导管移开液面.
(6)实验过程中,若缺少C装置,则发现产品浑浊不清,出现该现象的原因可用化学方程式表示为2S2Cl2+2H2O=3S↓+SO2↑+4HCl↑.实验完毕,当把剩余浓盐酸倒入E烧杯中与吸收了尾气的氢氧化钠溶液混合时,发现有少量黄绿色刺激性气体产生,产生该现象的原因是:ClO-+2H++Cl-=Cl2↑+H2O(用离子方程式表示).

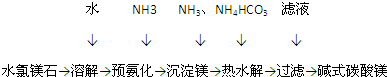
 硫代硫酸钠(Na2S2O3•5H2O)是一种脱氯剂,它易溶于水,难溶于乙醇,40~45℃熔化,48℃分解,由硫化钠和亚硫酸钠制备,涉及的反应原理为:
硫代硫酸钠(Na2S2O3•5H2O)是一种脱氯剂,它易溶于水,难溶于乙醇,40~45℃熔化,48℃分解,由硫化钠和亚硫酸钠制备,涉及的反应原理为: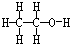 .
.