题目内容
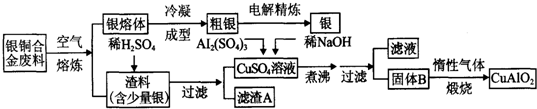
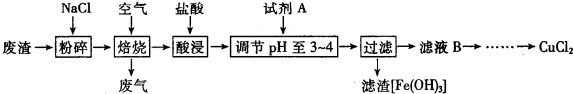
16.某炼铁废渣中含有大量CuS及少量铁的化合物(铁元素的化合价为+2和+3价),工业上以该废渣为原料生产CuCl2的工艺流程如下:CuS+2NaCl+2O2$\frac{\underline{\;高温\;}}{\;}$CuCl2+Na2SO4焙烧过程中发生的主要反应为:
回答下列问题:
(1)焙烧前先进行粉碎的理由是增大反应物接触面积,使燃烧更充分.
(2)试剂A可选用①③(填写编号).
①NaClO ②Cl2 ③H2O2溶液 ④浓流酸
加入试剂A的目的是将Fe2+氧化为Fe3+,并调节溶液的pH至3~4,使Fe3+沉淀.
(3)上述过滤操作中需要用到的玻璃仪器有漏斗、烧杯、玻璃棒.
(4)从CuCl2溶液得到CuCl2晶体的操作是蒸发结晶(写出操作名称),该操作必需在HCL气流中进行,原因是Cu2++2H2O?Cu(OH)2+2H+(用离子方程式表示).
(5)如何检验滤液B中是否还有未沉淀的Fe3+,取少量溶液于试管中,滴入KSCN溶液,若溶液显红色,证明还有未沉淀的Fe3+;加试剂A调节溶液pH=4时,c(Fe3+)为2.6×10-9mol/L.(已知该温度下Ksp[Fe(OH)3]=2.6×10-30)
分析 废渣粉碎加入氯化钠,通入空气焙烧后发生CuS+2NaCl+2O2$\frac{\underline{\;高温\;}}{\;}$CuCl2+Na2SO4,加入盐酸酸浸,加入试剂A是氧化剂将亚铁离子氧化为铁离子,调节溶液PH使铁离子沉淀;过滤后的滤液中主要是氯化铜溶液蒸发浓缩,冷却结晶得到氯化铜晶体;
(1)从反应速率角度考虑;
(2)试剂A满足能把亚铁离子氧化为铁离子和调节PH使酸性减弱两个功能;
(3)过滤是除去液体中混有的固体物质的一种方法,过滤用到的玻璃仪器有:烧杯、漏斗、玻璃棒.
(4)从溶液中得到可溶性固体采用蒸发结晶的方法;加热时促进氯化铜的水解且生成的氯化氢易挥发造成水解完全,
要想得到较纯的无水氯化铜应在氯化氢气流中抑制其水解;
(5)Fe3+遇KSCN溶液变为血红色,作为检验Fe3+的特征试剂;
依据氢氧化铁的溶度积常数和Fe3+沉淀完全的浓度为c(Fe3+)<10-5mol•L-1,计算氢氧根离子浓度得到溶液最小pH.
解答 解:废渣粉碎加入氯化钠,通入空气焙烧后加入盐酸酸浸,加入试剂A是氧化剂将亚铁离子氧化为铁离子,调节溶液PH使铁离子沉淀;过滤后的滤液中主要是氯化铜溶液蒸发浓缩,冷却结晶得到氯化铜晶体;
(1)粉碎增大了反应物接触面积,燃烧更充分,故答案为:增大反应物接触面积,使燃烧更充分;
(2)NaClO、Cl2、H2O2溶液、浓硫酸均能将Fe2+氧化为Fe3+,但氯水和硫酸溶液均呈酸性,NaClO溶液呈碱性,H2O2溶液氧化Fe2+氧化为Fe3+,消耗氢离子,故可以起到调节PH的作用,
故答案为:①③;将Fe2+氧化为Fe3+,并调节溶液的pH至3~4,使Fe3+沉淀;
(3)过滤是除去液体中混有的固体物质的一种方法,过滤用到的玻璃仪器有:烧杯、漏斗、玻璃棒;故答案为:烧杯、漏斗、玻璃棒;
(4)从溶液中得到可溶性固体采用蒸发结晶的方法;由于CuCl2在加热过程中水解被促进,且生成的HCl又易挥发而脱离体系,造成水解完全,
生成氢氧化铜,反应的离子方程式为:而不是CuCl2,想得到无水CuCl2的合理方法是,让CuCl2•2H2O晶体在干燥的HCl气流中加热脱水,
故答案为:蒸发结晶;Cu2++2H2O?Cu(OH)2+2H+;
(5)Fe3+遇KSCN溶液变为血红色,能检验Fe3+,取少量溶液于试管中,滴入KSCN溶液,若溶液显红色,证明还有未沉淀的Fe3+;
常温时,Fe(OH)3的Ksp=2.6×10-39,pH=4,c(H+)=10-4mol/L,c(OH-)=$\frac{Kw}{c(H{\;}^{+})}$=$\frac{10{\;}^{-14}}{10{\;}^{-4}}$10-10mol/L,
Ksp=c(Fe3+)c3(OH-)=c(Fe3+)×c3(OH-)=2.6×10-39,c(Fe3+)=$\frac{2.6×10{\;}^{-39}}{(10{\;}^{-10}){\;}^{3}}$=2.6×10-9mol/L,
故答案为:取少量溶液于试管中,滴入KSCN溶液,若溶液显红色,证明还有未沉淀的Fe3+;2.6×10-9mol/L.
点评 本题考查了物质的分离和提纯、离子的检验及沉淀溶解平衡,侧重于实验原理的考查,难度中等,注意除杂不能引入新的杂质.

| A. | 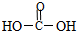 | B. | CCl4 | C. | 蔗糖 | D. | 合成纤维 |
| A. | 6.8g熔融的KHSO4中含有阳离子数0.05NA | |
| B. | 1mol冰醋酸和lmo1乙醇经催化加热反应可生成H2O分子数为NA | |
| C. | 乙烯和环丙烷(C3H6)组成的28g混合气体中含有3NA个氢原子 | |
| D. | 常温常压下,17g羟基中含有的电子数为10NA |
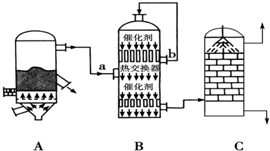
(1)图中设备A的名称是沸腾炉,B设备气流a、b温度较高的是b(填“a”或“b”),C设备中用浓硫酸吸收SO3.
(2)CuFeS2是黄铁矿的另一部分,煅烧时,CuFeS2转化为CuO、Fe2O3和SO2,该反应的化学方程式为:4CuFeS2+13O2$\frac{\underline{\;\;△\;\;}}{\;}$4CuO+2Fe2O3+8SO2.
Ⅱ为了回收利用SO2,研究人员研制了利用低品位软锰矿浆(主要成分是MnO2)吸收高温焙烧含硫废渣产生的SO2废气,制备硫酸锰晶体的生产流程,其流程示意图如下:
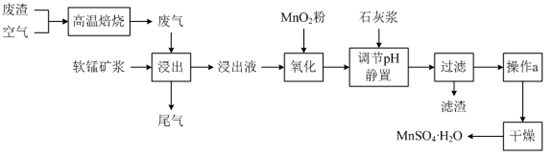
已知,浸出液的pH<2,其中的金属离子主要是Mn2+,还含有少量的Fe2+、Al3+等其他金属离子.有关金属离子形成氢氧化物沉淀时的pH见下表:
| 离子 | 开始沉淀时的pH | 完全沉淀时的pH |
| Fe2+ | 7.6 | 9.7 |
| Fe3+ | 2.7 | 3.7 |
| Al3+ | 3.8 | 4.7 |
| Mn2+ | 8.3 | 9.8 |
(1)写出浸出过程中主要反应的化学方程式:SO2+MnO2=MnSO4.
(2)写出氧化过程中主要反应的离子方程式:2Fe2++MnO2+4H+=2Fe3++Mn2++2H2O.
(3)在氧化后的液体中加入石灰浆,并用pH试纸测定调节pH,pH应调节范围是4.7≤pH<8.3.
(4)滤渣的主要成分有氢氧化铁、氢氧化铝、硫酸钙.
(5)下列各组试剂中,能准确测定尾气中SO2含量的是b、c.(填编号)
a.NaOH溶液、酚酞试液b.稀H2SO4酸化的KMnO4溶液
c.碘水、淀粉溶液d.氨水、酚酞试液.
(1)提出问题:Fe3+、Br2哪一个的氧化性更强?
(2)猜想
①甲同学认为氧化性:Fe3+>Br2,故上述实验现象不是发生化学反应所致,则溶液呈黄色是含Br2(填化学式,下同)所致.
②乙同学认为氧化性:Br2>Fe3+,故上述实验现象是发生化学反应所致,则溶液呈黄色是含Fe3+所致.
(3)设计实验并验证
丙同学为验证乙同学的观点,选用下列某些试剂设计出两种方案进行实验,并通过观察实验现象,证明了乙同学的观点确实是正确的.供选用的试剂:
a.酚酞试液 b.CCl4 c.无水酒精 d.KSCN溶液
请你在下列表格中写出丙同学选用的试剂及实验中观察到的现象.(试剂填序号)
| 选用试剂 | 实验现象 | |
| 方案1 | b | 下层(CCl4层)无色 |
| 方案2 | d | 溶液变为血红色 |
①在足量的稀氯化亚铁溶液中加入l~2滴溴水,溶液呈黄色,所发生的离子反应方程式为2Fe2++Br2═2Fe3++2Br-.
②在FeBr2溶液中通入足量 Cl2,所发生的离子反应方程式为4Fe2++2Br-+3Cl2═4Fe3++Br2+6Cl-.
| A. | 1mol/L Na2SO4溶液200mL | B. | 0.9mol/L Na3PO4溶液200mL | ||
| C. | 2.5mol/L NaOH 溶液100mL | D. | 1mol/L NaHCO3溶液300mL |
①取代反应; ②加成反应;③消去反应;④酯化反应;⑤加聚反应;⑥缩聚反应;⑦氧化反应;⑧还原反应.
| A. | ①②③④ | B. | ①②⑦⑧ | C. | ⑤⑥⑦⑧ | D. | ③④⑤⑥ |