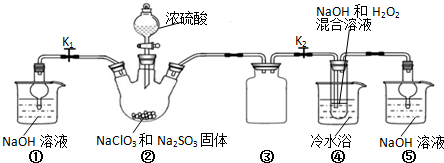
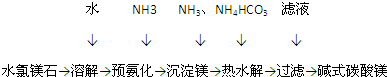
题目内容
20.高铁酸盐(K2FeO4)在能源、环保等方面有着广泛的用途.湿法、干法制备高铁酸盐的原理如下表所示.| 湿法 | 强碱性介质中,Fe(NO3)3与NaClO反应生成紫红色高铁酸盐溶液 |
| 干法 | Fe2O3、KNO3、KOH混合加热共熔生成紫红色高铁酸盐和KNO2等产物 |
(2)高铁酸钾在水中既能消毒杀菌,又能净水,是一种理想的水处理剂.它能消毒杀菌是因为高铁酸钾有强氧化性,它能净水的原因是高铁酸钾与水反应生成的Fe(OH)3胶体有吸附性.
(3)在实验室配置Fe(NO3)3溶液时,若用蒸馏水直接配置,所得溶液往往较混浊,其原因是(用离子方程式表示)Fe3++3H2O?Fe(OH)3+3H+,因此,正确的配置操作是在溶液中加入少量的(填试剂名称)硝酸,其目的是抑制铁离子的水解.
(4)Fe2O3是一种红棕色的氧化物,写出它和盐酸反应的离子方程式Fe2O3+6H+=3H2O+2Fe3+.
(5)检验Fe3+ 的方法很多,写出其中的一种检验方法取少量溶液于试管中,加入少量KSCN溶液,如果变成血红色溶液,则含有Fe3+.
分析 (1)干法Fe2O3、KNO3、KOH混合加热共熔生成紫红色高铁酸盐和KNO2等,所以反应为Fe2O3+3KNO3+4KOH$\frac{\underline{\;\;△\;\;}}{\;}$2K2FeO4+3KNO2+2H2O,Fe元素化合价升高,化合价由+3价升高到+6价,被氧化,N元素化合价由+5价降低到+2价,结合方程式判断;
(2)K2FeO4具有强氧化性,可用于杀菌消毒,可生成Fe(OH)3,具有吸附性;
(3)铁离子水解生成氢氧化铁和氢离子,溶液呈酸性,根据影响水解平衡移动的因素来回答;
(4)Fe2O3是一种红棕色的氧化物,它和盐酸反应生成氯化铁和水;
(5)检验Fe3+ 可用KSCN溶液.
解答 解:(1)干法Fe2O3、KNO3、KOH混合加热共熔生成紫红色高铁酸盐和KNO2等,所以反应为Fe2O3+3KNO3+4KOH$\frac{\underline{\;\;△\;\;}}{\;}$2K2FeO4+3KNO2+2H2O,Fe元素化合价升高,化合价由+3价升高到+6价,被氧化,N元素化合价由+5价降低到+2价,氧化剂与还原剂的物质的量之比为3:1,
故答案为:Fe2O3+3KNO3+4KOH$\frac{\underline{\;\;△\;\;}}{\;}$2K2FeO4+3KNO2+2H2O;3:1;
(2)K2FeO4具有强氧化性,可用于杀菌消毒,可生成Fe(OH)3,具有吸附性,可除去水的悬浮性杂质,
故答案为:高铁酸钾有强氧化性;高铁酸钾与水反应生成的Fe(OH)3胶体有吸附性;
(3)铁离子水解生成氢氧化铁和氢离子,Fe3++3H2O?Fe(OH)3+3H+,所以溶液往往较混浊,正确的配置操作是将Fe(NO3)3固体先溶于较浓的硝酸中,可以抑制铁离子的水解,故答案为:Fe3++3H2O?Fe(OH)3+3H+;硝酸;抑制铁离子的水解;
(4)Fe2O3是一种红棕色的氧化物,它和盐酸反应生成氯化铁和水,离子方程式为Fe2O3+6H+=3H2O+2Fe3+;故答案为:红棕;Fe2O3+6H+=3H2O+2Fe3+;
(5)检验Fe3+ 可用KSCN溶液,具体操作为取少量溶液于试管中,加入少量KSCN溶液,如果变成血红色溶液,则含有Fe3+;
故答案为:取少量溶液于试管中,加入少量KSCN溶液,如果变成血红色溶液,则含有Fe3+.
点评 本题考查实验方案设计与评价,为高考不变的一个题型,每年高考必考,是热点题型、也是高考难点之一.本题主要考查了氧化还原反应和离子反应方程式的书写、化学平衡的移动、胶体的净水原理.重点是利用化合价的升价和化学计量数判断氧化剂和还原剂的比例,难度中等.

 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案| A. | 实验室采用排饱和食盐水的方法收集Cl2 | |
| B. | 500℃左右的温度比室温更有利于合成氨反应 | |
| C. | H2、I2、HI平衡混合气体加压后颜色加深 | |
| D. | SO2氧化为SO3,往往需要使用催化剂 |
| A. | 标准状况下,64gCu与足量浓硝酸反应恰好生成2NA个NO2分子 | |
| B. | 120gNaHSO4固体中含有NA个阳离子 | |
| C. | Si-O键的键能大于Si-Cl键的键能,因此SiO2的熔点高于晶体SiCl4的熔点 | |
| D. | CO和N2为等电子体,22.4L的CO气体与lmol N2所含的电子数相等 |
| A. | 硫酸的摩尔质量是98 | |
| B. | 摩尔是阿伏加德罗常数个微粒的集合体 | |
| C. | 6.02Х1023就是阿伏加德罗常数 | |
| D. | 氧气的摩尔质量(单位:g•mol-1)在数值上等于它的相对分子质量 |
| A. | 硅酸、氯化铁均为胶体 | B. | 水玻璃、氯水均为混合物 | ||
| C. | 食醋、纯碱、食盐分别属于酸、碱盐 | D. | 氨气属于非电解质,Cu属于电解质 |