18.下列各组物质中,互为同分异构体的是( )
| A. | 2-甲基丙烷 正丁烷 | B. | 氧气 臭氧 | ||
| C. | 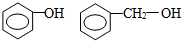 | D. | 金刚石 石墨 |
17.用于制造隐形飞机物质具有吸收微波的功能,其主要成分的结构如图,说法不正确的是( )
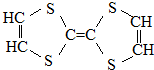

| A. | 它属于烃的衍生物 | B. | 所有的碳杂化方式相同 | ||
| C. | 属于高分子化合物 | D. | 它可以与氢气加成 |
16.丙烯酸结构如下,下列说法不正确的是( )
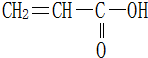
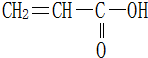
| A. | 它可以使溴的四氯化碳溶液褪色 | B. | 它可以使酸性高锰酸钾溶液褪色 | ||
| C. | 它与醋酸属于同系物 | D. | 它可与金属钠反应 |
13.下列各组物质中分子数一定相同的是( )
| A. | 标准状况下11.2L CO2和0.5 molCO2 | |
| B. | 18 mL H2O和2x10Pa,27C 16gO2 | |
| C. | 1 molCO和88gCO2 | |
| D. | 27℃,22.4 LCl2和含4mol氧原子的H2SO4 |
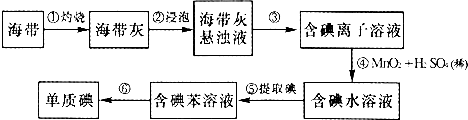
12.用含有A1203、SiO2和少量FeO•xFe2O3的铝灰制备A12(SO4)3•18H2O.,工艺流程如下(部分操作和条件略):
Ⅰ.向铝灰中加入过量稀H2SO4,过滤:
Ⅱ.向滤液中加入过量KMnO4溶液,调节溶液的pH约为3;
Ⅲ.加热,产生大量棕色沉淀,静置,上层溶液呈紫红色:
Ⅳ.加入MnSO4至紫红色消失,过滤;
Ⅴ.浓缩、结晶、分离,得到产品.
(1)H2S04溶解A12O3的离子方程式是Al2O3+6H+=2Al3++3H2O.
(2)请将KMnO4氧化Fe2+的离子方程式补充完整:
□MnO4-+□Fe2++□8H+=□Mn2++□Fe3++□4H2O
(3)生成各种氢氧化物沉淀的pH如下表(金属离子的起始浓度为0.1mol•L-1)
根据表中数据解释步骤Ⅱ的目的:pH约为3时,Fe2+和Al3+不能形成沉淀,将Fe2+氧化为Fe3+,可使铁完全沉淀.
(4)己知:一定条件下,MnO4-可与Mn2+反应生成MnO2,
①向Ⅲ的沉淀中加入浓HCl并加热,能说明沉淀中存在MnO2的现象是生成黄绿色气体.
②Ⅳ中加入MnS04的目的是除去过量的MnO4-.
Ⅰ.向铝灰中加入过量稀H2SO4,过滤:
Ⅱ.向滤液中加入过量KMnO4溶液,调节溶液的pH约为3;
Ⅲ.加热,产生大量棕色沉淀,静置,上层溶液呈紫红色:
Ⅳ.加入MnSO4至紫红色消失,过滤;
Ⅴ.浓缩、结晶、分离,得到产品.
(1)H2S04溶解A12O3的离子方程式是Al2O3+6H+=2Al3++3H2O.
(2)请将KMnO4氧化Fe2+的离子方程式补充完整:
□MnO4-+□Fe2++□8H+=□Mn2++□Fe3++□4H2O
(3)生成各种氢氧化物沉淀的pH如下表(金属离子的起始浓度为0.1mol•L-1)
| Al(OH)3 | Fe(OH)2 | Fe(OH)3 | |
| 开始沉淀时 | 3.4 | 6.3 | 1.5 |
| 完全沉淀时 | 4.7 | 8.3 | 2.8 |
(4)己知:一定条件下,MnO4-可与Mn2+反应生成MnO2,
①向Ⅲ的沉淀中加入浓HCl并加热,能说明沉淀中存在MnO2的现象是生成黄绿色气体.
②Ⅳ中加入MnS04的目的是除去过量的MnO4-.
11.用含有A1203、SiO2和少量FeO•xFe2O3的铝灰制备A12(SO4)3•18H2O,工艺流程如下(部分操作和条件略):
Ⅰ.向铝灰中加入过量稀H2SO4,过滤:
Ⅱ.向滤液中加入过量KMnO4溶液,调节溶液的pH约为3;
Ⅲ.加热,产生大量棕色沉淀,静置,上层溶液呈紫红色:
Ⅳ.加入MnSO4至紫红色消失,过滤;
Ⅴ.浓缩、结晶、分离,得到产品.
(1)H2S04溶解A1203的离子方程式是Al2O3+6H+=2Al3++3H2O
(2)MnO4- 氧化Fe2+的离子方程式补充完整:1MnO4-+5Fe2++8H+=1Mn2++5Fe3++4H2O
(3)已知:生成氢氧话务沉淀的pH
注:金属离子的起始浓度为0.1mol.L-1
根据表中数据解释步骤Ⅱ的目的:pH约为3时,Fe2+和Al3+不能形成沉淀,将Fe2+氧化为Fe3+,可使铁完全沉淀
(4)己知:一定条件下,MnO4- 可与Mn2+反应生成MnO2,
①向Ⅲ的沉淀中加入浓HCI并加热,能说明沉淀中存在MnO2的现象是生成黄绿色气体.
②Ⅳ中加入MnS04的目的是除去过量的MnO4-.
Ⅰ.向铝灰中加入过量稀H2SO4,过滤:
Ⅱ.向滤液中加入过量KMnO4溶液,调节溶液的pH约为3;
Ⅲ.加热,产生大量棕色沉淀,静置,上层溶液呈紫红色:
Ⅳ.加入MnSO4至紫红色消失,过滤;
Ⅴ.浓缩、结晶、分离,得到产品.
(1)H2S04溶解A1203的离子方程式是Al2O3+6H+=2Al3++3H2O
(2)MnO4- 氧化Fe2+的离子方程式补充完整:1MnO4-+5Fe2++8H+=1Mn2++5Fe3++4H2O
(3)已知:生成氢氧话务沉淀的pH
| Al(OH)3 | Fe(OH)2 | Fe(OH)3 | |
| 开始沉淀时 | 3.4 | 6.3 | 1.5 |
| 完全沉淀时 | 4.7 | 8.3 | 2.8 |
根据表中数据解释步骤Ⅱ的目的:pH约为3时,Fe2+和Al3+不能形成沉淀,将Fe2+氧化为Fe3+,可使铁完全沉淀
(4)己知:一定条件下,MnO4- 可与Mn2+反应生成MnO2,
①向Ⅲ的沉淀中加入浓HCI并加热,能说明沉淀中存在MnO2的现象是生成黄绿色气体.
②Ⅳ中加入MnS04的目的是除去过量的MnO4-.
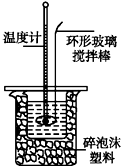
10. 某学生在实验室分别取50mL0.50mol/L盐酸和50mL0.55mol/LNaOH溶液用如图所示装置进行测定中和热的实验,并将实验数据记录如下:
某学生在实验室分别取50mL0.50mol/L盐酸和50mL0.55mol/LNaOH溶液用如图所示装置进行测定中和热的实验,并将实验数据记录如下:
请回答下列问题:
(1)理论上稀强酸、稀强碱反应生成1mol水时放出57.3kJ的热量,写出表示稀硫酸和稀氢氧化钠溶液反应的中和热的热化学方程式NaOH(aq)+$\frac{1}{2}$H2SO4(aq)═$\frac{1}{2}$Na2SO4(aq)+H2O(l)△H=-57.3 kJ/mol.
(2)经数据处理,t2-t1=3.4℃.则该实验测得的中和热△H=-56.8kJ/mol.
(3)假定该学生的操作完全同上,实验中改用100mL 0.50mol/L盐酸跟100mL 0.55mol/L NaOH溶液进行反应,与上述实验相比,所放出的热量不相等(填“相等”或“不相等”),所求中和热相等(填“相等”或“不相等”).
0 170555 170563 170569 170573 170579 170581 170585 170591 170593 170599 170605 170609 170611 170615 170621 170623 170629 170633 170635 170639 170641 170645 170647 170649 170650 170651 170653 170654 170655 170657 170659 170663 170665 170669 170671 170675 170681 170683 170689 170693 170695 170699 170705 170711 170713 170719 170723 170725 170731 170735 170741 170749 203614
 某学生在实验室分别取50mL0.50mol/L盐酸和50mL0.55mol/LNaOH溶液用如图所示装置进行测定中和热的实验,并将实验数据记录如下:
某学生在实验室分别取50mL0.50mol/L盐酸和50mL0.55mol/LNaOH溶液用如图所示装置进行测定中和热的实验,并将实验数据记录如下:| 实验次数 | 起始温度t1/℃ | 终止温度t2/℃ | |
| 盐酸 | NaOH溶液 | ||
| 1 | 20.2 | 20.3 | 23.7 |
| 2 | 20.3 | 20.5 | 23.8 |
| 3 | 21.5 | 21.6 | 24.9 |
(1)理论上稀强酸、稀强碱反应生成1mol水时放出57.3kJ的热量,写出表示稀硫酸和稀氢氧化钠溶液反应的中和热的热化学方程式NaOH(aq)+$\frac{1}{2}$H2SO4(aq)═$\frac{1}{2}$Na2SO4(aq)+H2O(l)△H=-57.3 kJ/mol.
(2)经数据处理,t2-t1=3.4℃.则该实验测得的中和热△H=-56.8kJ/mol.
(3)假定该学生的操作完全同上,实验中改用100mL 0.50mol/L盐酸跟100mL 0.55mol/L NaOH溶液进行反应,与上述实验相比,所放出的热量不相等(填“相等”或“不相等”),所求中和热相等(填“相等”或“不相等”).

 依据叙述,写出下列反应的热化学方程式.
依据叙述,写出下列反应的热化学方程式.