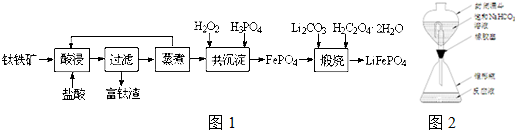
题目内容
15.为了从海带中提取碘,某研究性学习小组设计并进行了以下实验: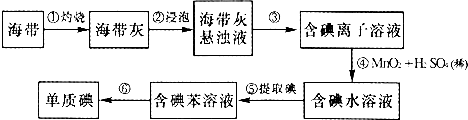
请填写下列空白:
(1)指出提取过程中有关实验操作的名称:③过滤,⑤萃取、分液.
(2)步骤④的反应中,氧化剂是MnO2(填化学式),氧化产物是I2(填化学式).
(3)步骤⑤中,某学生选择用苯来提取碘的理由是苯与水不互溶,碘在苯中的溶解度大于在水中的溶解度.
(4)通过蒸馏,可以将碘单质和苯分离开,即步骤⑥.某学生设计的蒸馏装置如图,指出该装置的两处错误:缺少石棉网、温度计插在溶液中②冷凝管进出水的方向颠倒.

分析 (1)分离固体和液体用过滤,将碘水转化为含碘的有机溶液,需用对卤素单质溶解能力强的有机溶剂把碘从碘水中提取出来,对应进行的实验操作是萃取;
(2)步骤④的反应是二氧化锰氧化碘离子为碘单质;
(3)利用碘易溶于有机溶剂的性质来进行提取,须注意:选择的能提取碘的试剂除了对I2有强的溶解能力处,还必须难溶于水,否则不能进行分液分离;
(4)烧杯加热应垫石棉网,温度计水银球应位于蒸馏烧瓶支管口处,冷凝管冷凝水下进上出.
解答 解:(1)将悬浊液分离为残渣和含碘离子溶液应选择过滤的方法.将碘水转化为含碘的有机溶液,需用对卤素单质溶解能力强的有机溶剂把碘从碘水中提取出来,对应进行的实验操作是萃取,故答案为:过滤、萃取、分液;
(2)二氧化锰氧化碘离子为碘单质,氧化剂为MnO2,氧化碘离子为碘单质,
故答案为:MnO2,I2;
(3)利用碘易溶于有机溶剂的性质来进行提取,须注意:选择的能提取碘的试剂除了对I2有强的溶解能力处,还必须难溶于水,否则不能进行分液分离,苯与水不互溶,碘在苯中的溶解度大于在水中的溶解度,可以萃取分液,
故答案为:苯与水不互溶,碘在苯中的溶解度大于在水中的溶解度;
(3)烧杯加热应垫石棉网,温度计水银球应位于蒸馏烧瓶支管口处,冷凝管冷凝水下进上出,
故答案为:①缺石棉网,温度计插到液体中;②冷凝管进出水方向颠倒;
点评 本题考查制备实验方案的设计,题目难度中等,注意基本实验操作的要点和注意事项.

练习册系列答案
 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案
相关题目
2.根据下列三个反应,判断物质的氧化性由强到弱的顺序正确的是( )
①2Fe3++2I-=2Fe2++I2 ②2Fe2++Cl2=2Fe3++2Cl-
③2MnO4-+10Cl-+16H+=2Mn2++5Cl2↑+8H2O.
①2Fe3++2I-=2Fe2++I2 ②2Fe2++Cl2=2Fe3++2Cl-
③2MnO4-+10Cl-+16H+=2Mn2++5Cl2↑+8H2O.
| A. | Fe3+>C12>MnO4- | B. | MnO4->Cl2>Fe3+ | C. | Fe3+>Cl2>I2 | D. | I2>Cl2>Fe3+ |
10. 某学生在实验室分别取50mL0.50mol/L盐酸和50mL0.55mol/LNaOH溶液用如图所示装置进行测定中和热的实验,并将实验数据记录如下:
某学生在实验室分别取50mL0.50mol/L盐酸和50mL0.55mol/LNaOH溶液用如图所示装置进行测定中和热的实验,并将实验数据记录如下:
请回答下列问题:
(1)理论上稀强酸、稀强碱反应生成1mol水时放出57.3kJ的热量,写出表示稀硫酸和稀氢氧化钠溶液反应的中和热的热化学方程式NaOH(aq)+$\frac{1}{2}$H2SO4(aq)═$\frac{1}{2}$Na2SO4(aq)+H2O(l)△H=-57.3 kJ/mol.
(2)经数据处理,t2-t1=3.4℃.则该实验测得的中和热△H=-56.8kJ/mol.
(3)假定该学生的操作完全同上,实验中改用100mL 0.50mol/L盐酸跟100mL 0.55mol/L NaOH溶液进行反应,与上述实验相比,所放出的热量不相等(填“相等”或“不相等”),所求中和热相等(填“相等”或“不相等”).
 某学生在实验室分别取50mL0.50mol/L盐酸和50mL0.55mol/LNaOH溶液用如图所示装置进行测定中和热的实验,并将实验数据记录如下:
某学生在实验室分别取50mL0.50mol/L盐酸和50mL0.55mol/LNaOH溶液用如图所示装置进行测定中和热的实验,并将实验数据记录如下:| 实验次数 | 起始温度t1/℃ | 终止温度t2/℃ | |
| 盐酸 | NaOH溶液 | ||
| 1 | 20.2 | 20.3 | 23.7 |
| 2 | 20.3 | 20.5 | 23.8 |
| 3 | 21.5 | 21.6 | 24.9 |
(1)理论上稀强酸、稀强碱反应生成1mol水时放出57.3kJ的热量,写出表示稀硫酸和稀氢氧化钠溶液反应的中和热的热化学方程式NaOH(aq)+$\frac{1}{2}$H2SO4(aq)═$\frac{1}{2}$Na2SO4(aq)+H2O(l)△H=-57.3 kJ/mol.
(2)经数据处理,t2-t1=3.4℃.则该实验测得的中和热△H=-56.8kJ/mol.
(3)假定该学生的操作完全同上,实验中改用100mL 0.50mol/L盐酸跟100mL 0.55mol/L NaOH溶液进行反应,与上述实验相比,所放出的热量不相等(填“相等”或“不相等”),所求中和热相等(填“相等”或“不相等”).
20.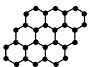 金刚石晶体结构中,每个碳原子与周围四个碳原子形成正四面体空间立体网状结构,则金刚石晶体中碳原子数与共价键之比是( )
金刚石晶体结构中,每个碳原子与周围四个碳原子形成正四面体空间立体网状结构,则金刚石晶体中碳原子数与共价键之比是( )
 金刚石晶体结构中,每个碳原子与周围四个碳原子形成正四面体空间立体网状结构,则金刚石晶体中碳原子数与共价键之比是( )
金刚石晶体结构中,每个碳原子与周围四个碳原子形成正四面体空间立体网状结构,则金刚石晶体中碳原子数与共价键之比是( )| A. | 1:2 | B. | 2:1 | C. | 1:4 | D. | 4:1 |
7.核电荷数分别是16和4的元素原子相比较,前者的下列数据是后者4倍的是( )
①质子数 ②最外层电子数 ③电子层数 ④电子总数.
①质子数 ②最外层电子数 ③电子层数 ④电子总数.
| A. | ①② | B. | ①④ | C. | ②③ | D. | ③④ |
4.如图为元素周期表中短周期的一部分,若X原子次外层电子数比最外层电子数多3,则下列说法正确的是( )
| R | ||
| X | Y | Z |
| A. | X的氢化物比R的氢化物稳定 | |
| B. | 原子半径大小顺序是Z>Y>X | |
| C. | Y元素能形成两种常见的含氧酸,其中一种是强酸 | |
| D. | XZ5分子中各原子均满足最外层8电子结构 |
5.下列有关有机物的叙述正确的是( )
| A. | 烃的组成均符合通式CnH2n+2 | |
| B. | 有机物均不溶于水 | |
| C. | 甲烷在同系物中含碳量最高,是清洁能源 | |
| D. | 甲烷能发生取代反应 |