11.很多餐馆使用的液化石油气主要成分是丁烷,在使用过程中,常有一些杂质以液态沉淀于钢瓶内,这些杂质是( )
| A. | 丙烷和丁烷 | B. | 乙烷和丙烷 | C. | 乙烷和丁烷 | D. | 戊烷和己烷 |
7.氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用.
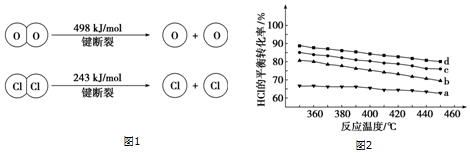
(1)如图1是1mol NO2气体和1mol CO反应生成CO2和NO过程中能量变化示意图,请写出NO2气体和CO反应的热化学方程式NO2(g)+CO(g)=NO(g)+CO2(g)△H=-234 kJ•mol-1.
(2)在固定体积的密闭容器中,进行如下化学反应:N2(g)+3H2(g)?2NH3(g)△H<0 该反应的化学平衡常数表达式是K=$\frac{{c}^{2}(N{H}_{3})}{c({N}_{2})•{c}^{3}({H}_{2})}$.已知平衡常数K与温度T的关系如表:
①试判断K1<K2(填写“>”“=”或“<”)
②下列各项能说明该反应已达到平衡状态的是c(填字母)
a.容器内N2、H2、NH3的浓度之比为1:3:2 b.v(N2)(正)=3v(H2)(逆)
c.容器内压强保持不变 d.混合气体的密度保持不变
③合成氨在农业和国防中有很重要的意义,在实际工业生产中,常采用下列措施,其中可以用勒夏特列原理解释的是BD(填字母).
A.采用较高温度(400℃~500℃) B.将生成的氨液化并及时从体系中分离出来
C.用铁触媒加快化学反应速率 D.采用较高压强(20MPa~50MPa)
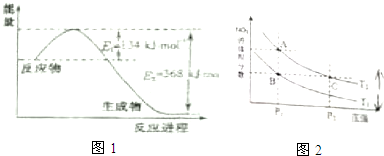
(3)对反应N2O4(g)?2NO2(g)△H>0,在温度分别为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图2所示,下列说法正确的是CD
a.A、C两点的反应速率:A>C
b.B、C两点的气体的平均相对分子质量:B<C
c.A、C两点N2O4的转化率:A<C
d.由状态B到状态A,可以用加热的方法.

(1)如图1是1mol NO2气体和1mol CO反应生成CO2和NO过程中能量变化示意图,请写出NO2气体和CO反应的热化学方程式NO2(g)+CO(g)=NO(g)+CO2(g)△H=-234 kJ•mol-1.
(2)在固定体积的密闭容器中,进行如下化学反应:N2(g)+3H2(g)?2NH3(g)△H<0 该反应的化学平衡常数表达式是K=$\frac{{c}^{2}(N{H}_{3})}{c({N}_{2})•{c}^{3}({H}_{2})}$.已知平衡常数K与温度T的关系如表:
| T/℃ | 400 | 300 |
| 平衡常致K | K1 | K2 |
②下列各项能说明该反应已达到平衡状态的是c(填字母)
a.容器内N2、H2、NH3的浓度之比为1:3:2 b.v(N2)(正)=3v(H2)(逆)
c.容器内压强保持不变 d.混合气体的密度保持不变
③合成氨在农业和国防中有很重要的意义,在实际工业生产中,常采用下列措施,其中可以用勒夏特列原理解释的是BD(填字母).
A.采用较高温度(400℃~500℃) B.将生成的氨液化并及时从体系中分离出来
C.用铁触媒加快化学反应速率 D.采用较高压强(20MPa~50MPa)
(3)对反应N2O4(g)?2NO2(g)△H>0,在温度分别为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图2所示,下列说法正确的是CD
a.A、C两点的反应速率:A>C
b.B、C两点的气体的平均相对分子质量:B<C
c.A、C两点N2O4的转化率:A<C
d.由状态B到状态A,可以用加热的方法.
5.室温,均为0.1 mol•L-1的NaHCO3与Na2CO3溶液中,下列判断不正确的是( )
| A. | 均存在电离平衡和水解平衡 | |
| B. | 存在的粒子种类相同 | |
| C. | c(OH-)前者大于后者 | |
| D. | 分别加入NaOH固体,恢复到原温度,c(CO32-)均增大 |
4.下列说法错误的是( )
| A. | 烧碱是强电解质,在水溶液中完全电离 | |
| B. | 将水加热,水的电离平衡向正反应方向移动,Kw变大 | |
| C. | 向溶液中加酸、加碱都能抑制水的电离 | |
| D. | 根据溶液导电能力强弱,将电解质分为强电解质、弱电解质 |
3.一定温度下,浓度均为0.1mol/L的下列溶液中,含H+离子浓度最小的是( )
| A. | CH3COOH | B. | H2SO4 | C. | HNO3 | D. | HCl |
2.某化学兴趣小组对二氧化碳与氢氧化钠反应后溶液中的溶质进行如下探究:向300mL 1mol/L的NaOH溶液中通入一定量CO2,充分反应后将溶液蒸发结晶,得到一定量的白色固体.
(1)该兴趣小组根据NaOH与CO2的反应,认为该白色固体的组成可能有以下几种情况:NaOH和Na2CO3、只有Na2CO3、只有NaHCO3、Na2CO3和NaHCO3.
(2)当通入标准状况下CO2的体积为2.24L时,该白色固体的组成为4 g NaOH和10.6 g Na2CO3(填写物质的化学式及对应质量).
①请设计实验方案进行实验验证.限选实验试剂:1mol•L-1 HCl溶液、1mol•L-1MgCl2溶液、0.5mol•L-1 BaCl2溶液、1mol•L-1Ba(OH)2溶液、甲基橙试液、酚酞试液.(步骤可不填满也可增加)
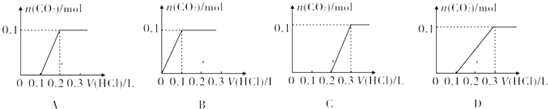
②将该白色固体配成溶液,向溶液中滴加1mol•L-1的盐酸.下列图象能正确表示加入盐酸的体积和生成CO2的物质的量的关系的是C.
0 170368 170376 170382 170386 170392 170394 170398 170404 170406 170412 170418 170422 170424 170428 170434 170436 170442 170446 170448 170452 170454 170458 170460 170462 170463 170464 170466 170467 170468 170470 170472 170476 170478 170482 170484 170488 170494 170496 170502 170506 170508 170512 170518 170524 170526 170532 170536 170538 170544 170548 170554 170562 203614
(1)该兴趣小组根据NaOH与CO2的反应,认为该白色固体的组成可能有以下几种情况:NaOH和Na2CO3、只有Na2CO3、只有NaHCO3、Na2CO3和NaHCO3.
(2)当通入标准状况下CO2的体积为2.24L时,该白色固体的组成为4 g NaOH和10.6 g Na2CO3(填写物质的化学式及对应质量).
①请设计实验方案进行实验验证.限选实验试剂:1mol•L-1 HCl溶液、1mol•L-1MgCl2溶液、0.5mol•L-1 BaCl2溶液、1mol•L-1Ba(OH)2溶液、甲基橙试液、酚酞试液.(步骤可不填满也可增加)
| 实验步骤 | 预期现象和结论 |
| 步骤1: | |
| 步骤2: | |
| 步骤3: |

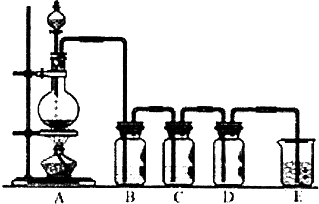 (1)若利用如图装置制备纯净、干燥的氯气,装置A中反应的化学方程式为MnO2+4HCl$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O.则装置B中的液体是饱和NaCl溶液;装置C中试剂的作用是干燥氯气
(1)若利用如图装置制备纯净、干燥的氯气,装置A中反应的化学方程式为MnO2+4HCl$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O.则装置B中的液体是饱和NaCl溶液;装置C中试剂的作用是干燥氯气