题目内容
4.下列说法错误的是( )| A. | 烧碱是强电解质,在水溶液中完全电离 | |
| B. | 将水加热,水的电离平衡向正反应方向移动,Kw变大 | |
| C. | 向溶液中加酸、加碱都能抑制水的电离 | |
| D. | 根据溶液导电能力强弱,将电解质分为强电解质、弱电解质 |
分析 A、常见的强电解质有强酸、强碱、绝大多数的盐和金属氧化物;
B、水的电离吸热;
C、根据水的电离方程式H2O?H++OH-来分析;
D、在水溶液中能完全电离的电解质为强电解质,在水溶液中部分电离的电解质为弱电解质.
解答 解:A、常见的强电解质有强酸、强碱、绝大多数的盐和金属氧化物,烧碱为NaOH,是强电解质,在水溶液中完全电离,故A正确;
B、水的电离吸热,故温度升高,水的电离平衡右移,Kw增大,故B正确;
C、根据水的电离方程式H2O?H++OH-可知:加酸或加碱均能使水的电离平衡左移,能抑制水的电离,故C正确;
D、在水溶液中能完全电离的电解质为强电解质,在水溶液中部分电离的电解质为弱电解质,故强弱电解质的本质区别是能否完全电离,故D错误.
故选D.
点评 本题考查了强弱电解质的区别以及电离平衡的移动,应注意的是强弱电解质的本质区别是能否完全电离.

练习册系列答案
相关题目
14.下列各组物质,化学键类型相同、晶体类型相同且熔化时破坏作用力类型也相同的( )
| A. | HCl KCl | B. | CO2 SiO2 | C. | NH4Cl CCl4 | D. | NaOH Na2O2 |
12.下列判断正确的是( )
| A. | 电负性:O>F | B. | 第一电离能:K>Na | ||
| C. | 未成对电子数:N>C | D. | o-键数:C2H2>CH4 |
19.2008年9月25日晚9时10分,我国“神舟七号”载人飞船顺利升入太空.此次火箭的主要燃料是偏二甲肼(用R表示)和四氧化二氮,在火箭发射时,两者剧烈反应产生大量气体并释放出大量的热,该反应的化学方程式为:R+2N2O4═3N2↑+4H2O↑+2CO2↑,下列叙述错误的是( )
| A. | 此反应是氧化还原反应 | |
| B. | 反应瞬间产生大量高温气体,推动火箭飞行 | |
| C. | 在反应中N2O4做还原剂 | |
| D. | R的分子式为C2H8N2 |
13.下列说法正确的( )
| A. | 燃料的燃烧反应、酸碱中和反应均是放热反应 | |
| B. | 化学反应释放或吸收能量的多少与反应物或产物的量无关 | |
| C. | 反应物的总能量小于生成物的总能量的反应是放热反应 | |
| D. | 放热反应一定不需要加热就能发生 |

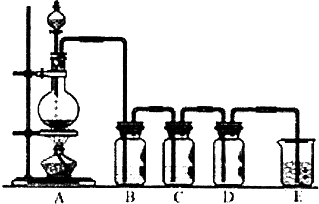 (1)若利用如图装置制备纯净、干燥的氯气,装置A中反应的化学方程式为MnO2+4HCl$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O.则装置B中的液体是饱和NaCl溶液;装置C中试剂的作用是干燥氯气
(1)若利用如图装置制备纯净、干燥的氯气,装置A中反应的化学方程式为MnO2+4HCl$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O.则装置B中的液体是饱和NaCl溶液;装置C中试剂的作用是干燥氯气