题目内容
10.化学与环境密切相关.(1)下列有关说法正确的是ACD
A.光化学烟雾是氮氧化物与碳氢化合物受紫外线作用后产生的有毒烟雾.
B.PH小于7的雨水都是酸雨
C.PM2.5含量的增加是形成雾霾天气的重要原因之一
D.大气中CO2含量的增加会导致温室效应加剧
(2)某地区的雾霾中可能含有如下几种无机离子:Na+、NH4+、Mg2+、Al3+、SO42-、NO3-、Cl-.对该地区雾霾处理后获得试样溶液进行了如下的实验:
已知:3NO3-+8Al+5OH-+18H2O═3NH3↑+8[Al(OH)4]-
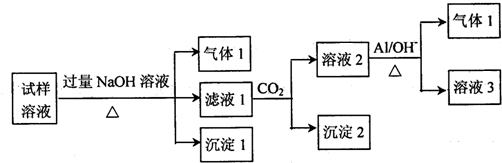
请回答下列问题:
①试样溶液加入过量NaOH溶液后生成沉淀Ⅰ的化学式是Mg(OH)2.生成气体Ⅰ的离子方程式为NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O,检验该气体的方法是将湿润的红色石蕊试纸粘在玻璃棒上,靠近集气瓶口若试纸变蓝,则说明该气体为氨气.
(2)根据实验结果,推测出雾霾中一定含有的离子有NH4+、Mg2+、Al3+、NO3-,若要确定原试样溶液存在的其它阴离子,可在试样溶液中先加入足量的Ba(NO3)2溶液,再取上层清液加入AgNO3溶液.
分析 (1)A、大气中的碳氢化合物和NOx等为一次污染物,在太阳光中紫外线照射下能发生化学反应,衍生种种二次污染物.由一次污染物和二次污染物的混合物(气体和颗粒物)所形成的烟雾污染现象,称为光化学烟雾;
B、酸雨是指pH<5.6的降水;
C、PM2.5是形成雾霾天气罪魁祸首;
D、二氧化碳会导致温室效应.
(2)试样溶液中加入过量NaOH并加热,生成的气体1,该气体1可能是NH3,则试样中含有NH4+;生成的沉淀1为Mg(OH)2,说明原溶液中含Mg2+;向滤液中通入CO2,得到溶液2、沉淀2,溶液2中加入Al,NO3-+A1+OH-+H2O→NH3↑+[Al(OH)4]-,生成气体2,该气体是NH3,根据已知条件知,溶液2中含有NO3-,根据元素守恒知,原溶液中含有NO3-;滤液1中通入CO2,得到沉淀2,则沉淀2为Al(OH)3,说明原溶液中含Al3+,据此分析.
解答 解:(1)A、光化学烟雾是汽车、工厂等污染源排入大气的碳氢化合物(HC)和氮氧化物(NOx)等一次污染物在阳光(紫外光)作用下会发生光化学反应生成二次污染物,故A正确;
B、由于空气中二氧化碳的溶入,正常的降雨的pH也小于7,而酸雨是指pH<5.6的降水,故B错误;
C、PM2.5是形成雾霾天气罪魁祸首,是导致雾霾的主要原因之一,故C正确;
D、二氧化碳会导致温室效应,是形成温室效应的主要原因,故D正确.
故选ACD.
(2)试样溶液中加入过量NaOH并加热,生成的气体1,该气体1只能是NH3,则试样中含有NH4+;由于氢氧化钠过量,故生成的沉淀1为Mg(OH)2,说明原溶液中含Mg2+;如果原溶液中含Al3+,则与过量的氢氧化钠反应转化为了AlO2-,故滤液1中可能含AlO2-、SO42-、NO3-、Cl-,一定含Na+和OH-.则向滤液1中通入CO2,得到溶液2,溶液2中加入Al,生成气体2,根据信息所给的反应NO3-+A1+OH-+H2O→NH3↑+[Al(OH)4]-,该气体是NH3,根据已知条件知,溶液2中含有NO3-,根据元素守恒知,原溶液中含有NO3-;还得到沉淀2,则说明滤液1中含AlO2-,即原溶液中含Al3+.
故溶液中一定存在的离子是NH4+、Mg2+、Al3+、NO3-;Na+、SO42-、Cl-的存在不能确定.
①试样溶液加入过量NaOH溶液后生成沉淀Ⅰ为Mg(OH)2;气体Ⅰ的生成是溶液中的铵根离子与氢氧根反应生成的:NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O;由于氨气是唯一的碱性气体,故检验的方法为:将湿润的红色石蕊试纸粘在玻璃棒上,靠近集气瓶口若试纸变蓝,则说明该气体为氨气.故答案为:
Mg(OH)2;NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O;将湿润的红色石蕊试纸粘在玻璃棒上,靠近集气瓶口若试纸变蓝,则说明该气体为氨气.
②经过上述分析,雾霾中国一定含有的离子为NH4+、Mg2+、Al3+、NO3-;由于不能确定的阴离子有SO42-、Cl-,而检验SO42-用钡盐,检验Cl-用硝酸银,而由于Ag+既能与SO42-又能与Cl-反应,而Ba2+只与SO42-反应,故应先向溶液中加入Ba(NO3)2,若有白色沉淀生成,则说明溶液中有SO42-;然后取上层清液,加入硝酸银,如果有白色沉淀生成,则溶液中含Cl-.
故答案为:NH4+、Mg2+、Al3+、NO3-;Ba(NO3)2; AgNO3.
点评 本题考查了物质的推断,明确物质的性质及特殊反应现象是解本题关键,根据物质的溶解性、物质的性质及题给信息来分析解答,题目难度中等.

 好成绩1加1期末冲刺100分系列答案
好成绩1加1期末冲刺100分系列答案 金状元绩优好卷系列答案
金状元绩优好卷系列答案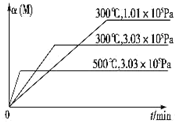 在一个密闭绝热容器(W)中,进行如下两个可逆反应:①A(g)+2B(g)?3C(g)+D(s)△H1>0,②xM(g)+N(g)?3Q(g)△H2.反应①中各物质与反应②中各物质均不发生反应.在某容器里只进行反应②,M的转化率与温度、压强的关系如图所示.下列对W容器中进行的反应推断合理的是( )
在一个密闭绝热容器(W)中,进行如下两个可逆反应:①A(g)+2B(g)?3C(g)+D(s)△H1>0,②xM(g)+N(g)?3Q(g)△H2.反应①中各物质与反应②中各物质均不发生反应.在某容器里只进行反应②,M的转化率与温度、压强的关系如图所示.下列对W容器中进行的反应推断合理的是( )| A. | 反应①一定是自发反应,反应②一定是非自发反应 | |
| B. | 若容器内温度保持不变,则v正(B):v逆(C)=2:3 | |
| C. | 若恒压条件下,充入N,则C的物质的量减小 | |
| D. | 升高温度,两个反应的平衡常数都减小 |
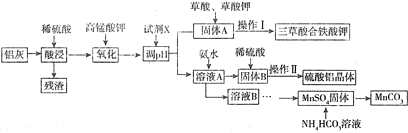
已知:生成氢氧化物的pH
| Al(OH)3 | Fe(OH)3 | |
| 开始沉淀时 | 3.6 | 2.1 |
| 完全沉淀时 | 5.2 | 3.2 |
(1)为提高酸浸速率,应采用的措施是(答出两条)适当提高硫酸的浓度、加热、搅拌,残渣的主要成分是SiO2;
(2)写出氧化过程中反应的了新方程式MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O;
(3)试剂X的化学式是Al2O3或Al(OH)3,pH的调控范围是3.2≤pH<3.6;
(4)操作Ⅱ的晶体步骤为蒸发浓缩、降温结晶,过滤洗涤、低温干燥,若操作Ⅰ与操作Ⅱ相同,则洗涤三草酸合铁酸钾以获得干燥晶体的试剂最好是b;
a.先热水后酒精 b.先冷水后酒精 c.先酒精后热水 d.先酒精后冷水
(5)生成MnCO3沉淀的离子方程式为Mn2++2HCO3-=MnCO3↓+H2O+CO2↑.
| A. | 在氧气中,铷(Rb)的燃烧产物比钠的燃烧产物更复杂 | |
| B. | 砹(At)为有色固体,AgAt难溶于水也不溶于稀硝酸 | |
| C. | 锂(Li)与水反应比钠与水反应剧烈 | |
| D. | HBrO4的酸性比HIO4的酸性强 |
| A. | 均存在电离平衡和水解平衡 | |
| B. | 存在的粒子种类相同 | |
| C. | c(OH-)前者大于后者 | |
| D. | 分别加入NaOH固体,恢复到原温度,c(CO32-)均增大 |
| A. | 可以在空气中燃烧 | |
| B. | 与氯气发生取代反应 | |
| C. | 不能使高锰酸钾溶液褪色 | |
| D. | 可以与溴水中的溴反应而使溴水褪色 |
| A. | SO2、O2 | B. | SO2、SO3 | C. | SO2、O2、SO3 | D. | O2、SO3 |
| A. | 气体分子微粒的大小 | B. | 气体分子所含微粒的数目 | ||
| C. | 气体分子间平均距离的大小 | D. | 气体分子间作用力的大小 |