题目内容
7.氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用.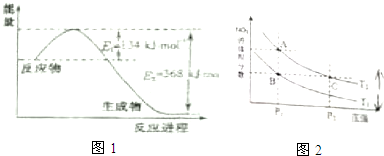
(1)如图1是1mol NO2气体和1mol CO反应生成CO2和NO过程中能量变化示意图,请写出NO2气体和CO反应的热化学方程式NO2(g)+CO(g)=NO(g)+CO2(g)△H=-234 kJ•mol-1.
(2)在固定体积的密闭容器中,进行如下化学反应:N2(g)+3H2(g)?2NH3(g)△H<0 该反应的化学平衡常数表达式是K=$\frac{{c}^{2}(N{H}_{3})}{c({N}_{2})•{c}^{3}({H}_{2})}$.已知平衡常数K与温度T的关系如表:
| T/℃ | 400 | 300 |
| 平衡常致K | K1 | K2 |
②下列各项能说明该反应已达到平衡状态的是c(填字母)
a.容器内N2、H2、NH3的浓度之比为1:3:2 b.v(N2)(正)=3v(H2)(逆)
c.容器内压强保持不变 d.混合气体的密度保持不变
③合成氨在农业和国防中有很重要的意义,在实际工业生产中,常采用下列措施,其中可以用勒夏特列原理解释的是BD(填字母).
A.采用较高温度(400℃~500℃) B.将生成的氨液化并及时从体系中分离出来
C.用铁触媒加快化学反应速率 D.采用较高压强(20MPa~50MPa)
(3)对反应N2O4(g)?2NO2(g)△H>0,在温度分别为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图2所示,下列说法正确的是CD
a.A、C两点的反应速率:A>C
b.B、C两点的气体的平均相对分子质量:B<C
c.A、C两点N2O4的转化率:A<C
d.由状态B到状态A,可以用加热的方法.
分析 (1)由图可知,1mol NO2和1mol CO反应生成CO2和NO放出热量368-134=234kJ,根据热化学方程式书写原则进行书写;
(2)依据平衡常数等于平衡生成物浓度的幂次方乘积除以反应物浓度的幂次方乘积;
①根据降低温度平衡放热方向移动以及平衡正向移动平衡常数增大;
②直接标志:1、速率关系:正反应速率与逆反应速率相等;2、反应体系中各物质的百分含量保持不变;
③化学平衡移动原理是指温度、浓度、压强等因素对化学平衡的移动造成的影响;
(3)a.A、C两点都在等温线上,压强越大,反应速率越快;
b.B和C的体积分数相等;
c.A、C两点都在等温线上,压强增大,平衡向气体体积减少的方向移动;
d.该反应为吸热反应,升高温度平衡向逆反应方向移动.
解答 解:(1)由图可知,1mol NO2和1mol CO反应生成CO2和NO放出热量368-134=234kJ,反应热化学方程式为NO2(g)+CO(g)=NO(g)+CO2(g)△H=-234 kJ•mol-1,故答案为:NO2(g)+CO(g)=NO(g)+CO2(g)△H=-234 kJ•mol-1;
(2)N2(g)+3H2(g)?2NH3(g)△H<0,平衡常数计算表达式K=$\frac{{c}^{2}(N{H}_{3})}{c({N}_{2})•{c}^{3}({H}_{2})}$,故答案为:$\frac{{c}^{2}(N{H}_{3})}{c({N}_{2})•{c}^{3}({H}_{2})}$;
①根据降低温度平衡放热方向移动以及平衡正向移动平衡常数增大,所以K1<K2,故答案为:<;
②a.平衡时反应混合物中各组分的含量保持不变,但容器内N2、H2、NH3的浓度之比不一定为为1:3:2,所以不能作为平衡的标志,故a错误;
b.平衡时不同物质表示速率之比等于系数之比说明到达平衡,即3v(N2)正=v(H2)逆说明反应达到平衡,故b错误;
c.反应前后气体体积减小,若压强不变,说明反应达到平衡,故c正确;
d.反应前后气体的质量不变,容器的体积不变,所以密度不变,所以混合气体的密度保持不变不能作为平衡的标志,故d错误;
故选:c;
③A.加热到500℃合成氨是放热反应,升温会使平衡逆向移动,降低转化率,升温的目的是为了保证催化剂的催化活性,加快化学反应速率,不能用勒夏特列原理解释,故错误;
B.将生成的氨液化并及时从体系中分离出来,将氨及时液化分离,利于化学平衡正向移动,有利于氨的合成,故正确;
C.用铁作催化剂加快化学反应速率,催化剂不能使平衡移动,使用催化剂是为了加快化学反应速率,用勒夏特列原理无法解释,故错误;
D.采用较高压强(20Mpa-50MPa),合成氨是气体体积减小的反应,加压至20~50MPa,有利于化学平衡正向移动,有利于氨的合成,故正确;
故选:BD;
(3)A.A、C两点都在等温线上,压强越大,反应速率越快,所以速率:C>A,故A错误;
B.B和C的体积分数相等,所以B、C两点的气体的平均相对分子质量相等,故B错误;
C.A、C两点都在等温线上,C点压强更高,压强增大,平衡向气体体积减少的方向移动,即逆反应方向移动,N2O4的转化率降低,所以两点N2O4的转化率:A>C,故C正确;
D.该反应为吸热反应,升高温度平衡向正反应方向移动,NO2的体积分数增大,所以由状态B到状态A,可以用加热的方法,故D正确;
故选:CD.
点评 本题主要考查了热化学方程式的书写、化学平衡常数、化学平衡的图象、平衡状态的判断等,题目难度中等,侧重对学生能力的考查.

| A. | 用量筒量取5.26ml盐酸 | |
| B. | 用托盘天平称取11.70g食盐 | |
| C. | 用PH试纸测得溶液的PH是3.5 | |
| D. | 用标准NaOH溶液滴定未知浓度的盐酸用去23.10ml NaOH溶液 |
| A. | 向某溶液中滴加KSCN溶液,若溶液出现血红色则说明原溶液中含Fe3+ | |
| B. | 向某溶液中滴加BaCl2溶液,若有白色沉淀,再滴加足量稀HNO3,若沉淀不溶解,则说明原溶液中一定含Ag+ | |
| C. | 向某溶液中滴加足量稀HCl,产生气体能使澄清石灰水变浑浊,则说明原溶液中一定含CO32- | |
| D. | 向某溶液中滴加NaOH溶液,除溶液体积增大外,无其它现象,说明该溶液与NaOH溶液不反应. |
| A. | x的原子半径大于y的原子半径 | |
| B. | x的电负性大于y的电负性 | |
| C. | x的核电荷数大于y的核电荷数 | |
| D. | x的第一电离能小于y 的第一电离能 |
(1)该兴趣小组根据NaOH与CO2的反应,认为该白色固体的组成可能有以下几种情况:NaOH和Na2CO3、只有Na2CO3、只有NaHCO3、Na2CO3和NaHCO3.
(2)当通入标准状况下CO2的体积为2.24L时,该白色固体的组成为4 g NaOH和10.6 g Na2CO3(填写物质的化学式及对应质量).
①请设计实验方案进行实验验证.限选实验试剂:1mol•L-1 HCl溶液、1mol•L-1MgCl2溶液、0.5mol•L-1 BaCl2溶液、1mol•L-1Ba(OH)2溶液、甲基橙试液、酚酞试液.(步骤可不填满也可增加)
| 实验步骤 | 预期现象和结论 |
| 步骤1: | |
| 步骤2: | |
| 步骤3: |
| A. | CH3-CH3与Cl2在光照下发生取代反应 | |
| B. | CH3CH=CHCH3与Br2在四氯化碳溶液里发生加成反应 | |
| C. | CH3-CH=CH2和HCl发生加成反应 | |
| D. | 甲苯与溴混合后再加入铁粉时发生反应 |
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | ① | ② | ||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
| 4 | ⑨ | ⑩ |
(2)表中最活泼的金属是K,非金属性最强的元素是F(填元素符号,下同)
(3)表中能形成两性氢氧化物的元素是Al,分别写出该元素的氢氧化物与⑥和⑨的最高价氧化物的水化物反应的化学方程式2Al(OH)3+3H2SO4═Al2(SO4)3+6H2O、Al(OH)3+KOH═KAlO2+2H2O.
(4)②、⑦、⑩三种元素的气态氢化物最稳定的是HF.
(5)写出⑤的最高价氧化物与⑨的最高价氧化物的水化物反应方程式SiO2+2KOH═K2SiO3+H2O.
| A. | v(O2)=0.010 mol•L-1•s-1 | B. | v(NO)=0.008 mol•L-1•s-1 | ||
| C. | v(H2O)=0.006 mol•L-1•s-1 | D. | v(NH3)=0.002 mol•L-1•s-1 |
| A. | 加入数滴氯化铜溶液 | B. | 加入适量的6 mol•L-1的盐酸 | ||
| C. | 加入适量蒸馏水 | D. | 加入适量的氯化钠溶液 |